Las manoproteínas son proteínas unidas a moléculas de azúcar (pertenecientes por ello al grupo de las glucoproteínas), concretamente a restos de manosa, en una proporción que varía entre el 50 y el 90%. Se encuentran fundamentalmente en la capa externa de la pared de las levaduras, en general, y de la levadura vínica por excelencia, Saccharomyces cerevisiae, en particular. Desde el punto de vista estructural, la pared es a la levadura como la cáscara al huevo: una estructura semirrígida que limita el espacio celular más allá de la membrana plasmática, y que es fundamental para que S. cerevisiae lleve a cabo sus funciones de nutrición, relación y reproducción.
Varios son los alimentos que contienen de manera natural manoproteínas provenientes de la pared de las levaduras, el vino entre ellos, y se ingieren con el mismo de forma natural, por lo que se trata de un grupo de compuestos GRAS (Generally Regarded As Safe). En la actualidad son utilizadas como coadyuvantes tecnológicos en la industria enológica para evitar diversos problemas, tales como la precipitación tartárica o proteica. También se las relaciona positivamente con la estabilidad del color, la contribución a dar untuosidad y disminuir la astringencia en vinos tintos, la fijación de algunos componentes aromáticos y la mejora de la calidad de la espuma del cava.1
Sin embargo, ha sido escasa la atención prestada hasta ahora a los aspectos de las manoproteínas relacionados con la seguridad y funcionalidad del vino; aspectos de máxima relevancia tanto para el sector como para el consumidor y directamente relacionados con la calidad higiénico-sanitaria y nutricional del mismo.2 En el presente artículo comentamos un estudio realizado recientemente en nuestro laboratorio sobre la relación entre las manoproteínas y la OTA.3
La OTA es una micotoxina producida por hongos de los géneros Aspergillus y Penicillium, nefrotóxica, teratogénica, hepatotóxica y carcinogénica, por lo que la Organización Internacional de la Viña y el Vino (OIV) propuso el límite de 2 μg/L como la concentración máxima aceptable en vinos4 siendo establecido definitivamente por la Unión Europea como el límite máximo de OTA que se puede admitir en mostos y vinos a partir de la vendimia del año 2005.
La OIV en su Resolución VITI-OENO 1/2005 publicó el «Código de buenas prácticas vitivinícolas para limitar al máximo la presencia de ocratoxina A en los productos derivados de la viña». Limitar al máximo el nivel de OTA son sólo las denominadas medidas preventivas en el Análisis de Peligros y Puntos de Control Crítico (APPCC), sistema de aseguramiento y mejora de la calidad higiénico-sanitaria de obligado cumplimiento por Real Decreto 2207/1995, en el que se establecen las normas de higiene relativas a los productos alimenticios. Hemos desarrollado por primera vez la aplicación del APPCC para el control de OTA en vinos, y señalado como punto de control crítico (PCC) la operación de clasificación y selección de la uva a procesar, y el almacenamiento de la misma si lo hubiere.6-10 Por tanto, las buenas prácticas vitivinícolas son tan sólo un elemento de los que consta el sistema APPCC.
Una vez que un vino tiene una concentración de OTA superior a la permitida, su dilución es una práctica prohibida.11 Entre los procedimientos de descontaminación estudiados hasta el momento, el empleo de lías de levadura o paredes celulares parece ser uno de los más prometedores,12-14 debido fundamentalmente al papel determinante que juegan las levaduras en el proceso de fermentación. Se ha observado que la capacidad descontaminante de las levaduras depende de la cepa utilizada, y aunque existen controversias en cuanto al mecanismo implicado en este proceso, es la adsorción de la toxina la hipótesis más aceptada. En este contexto, algunas levaduras actuarían como «esponjas» adsorbiendo la OTA presente en el vino durante el proceso de elaboración. También con las bacterias lácticas sucede algo similar.15,16 Sin embargo, no se ha estudiado cómo se afectaría la capacidad de adsorción de las lías debido a su envejecimiento con el vino. Durante este proceso, tiene lugar la autolisis de las levaduras, autodegradación celular que comienza una vez que la célula muere y en el que se hidrolizan tanto estructuras intracelulares como diversos componentes de la pared celular. Precisamente, en este estudio se evalúa la influencia de la autolisis en la capacidad de eliminación de la OTA por parte de las levaduras y paredes de las mismas.
Estudios experimentales realizados
Toda la metodología desarrollada se encuentra previamente descrita.3 Como material biológico se utilizó la levadura Saccharomyces cerevisiae en forma de levadura seca activa y en forma de paredes celulares, productos comerciales en ambos casos. Se hicieron varios experimentos. Una sesión consistió en poner en contacto en un vino modelo, de condiciones controladas e idénticas en todos los casos –no se hizo con vino real para evitar la variabilidad existente, que podría haber influido en el estudio, así como la existencia de trazas de azúcar que habrían evitado a las levaduras entrar en autolisis- las levaduras vivas, y someterlas a autolisis. Se estudió la variación de OTA en el sobrenadante, así como la variación de la concentración de proteínas y aminoácidos y manoproteínas. Se hizo una sesión similar con las cáscaras, y una tercera en la que a las cáscaras se les había dado un previo tratamiento térmico suave. La concentración de OTA en el medio modelo fue de 10 μg/L y la concentración final de levaduras y cáscaras fue de 1 g/L. Los datos resultantes fueron analizados estadísticamente.
En la figura 1 se muestran los resultados obtenidos en la eliminación de la OTA presente en el vino modelo. Las levaduras adsorbieron en las 2 primeras horas aproximadamente un 30% de la OTA presente en el medio, mientras que el valor máximo de adsorción de la preparación de cáscaras utilizada fue menor (22%). Con el transcurso de la autolisis se pudo comprobar como la OTA adherida a las levaduras se libera nuevamente al medio vínico, llegando a alcanzar desde las 166 horas prácticamente la concentración inicial.
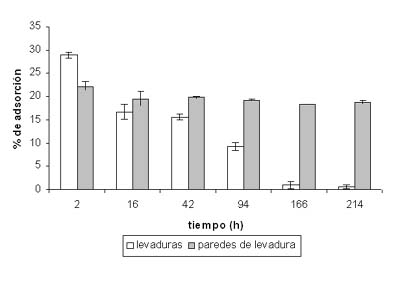
Sin embargo, el comportamiento observado en el caso de las paredes fue significativamente diferente (p < 0,05), y su capacidad de descontaminación fue bastante más estable, pasando de un valor máximo del 22% a las 2 horas hasta aproximadamente un 18 % al final del experimento. El estudio indirecto de la autolisis mediante el análisis de la concentración de proteínas y aminoácidos liberados al medio vínico modelo permitió confirmar que el patrón de liberación de la OTA de las paredes celulares de las levaduras coincidió con etapas avanzadas del proceso de autolisis (más de 100 h de incubación). En etapas avanzadas de la autolisis, los enzimas hidrolíticos activos actúan sobre diversos componentes de la pared celular, creando poros de gran tamaño que incluso permiten el paso de los enzimas al medio extracelular.
Estos resultados sugieren que en el proceso de eliminación de la toxina por adsorción aparecen implicados compuestos de la pared celular de las levaduras que se afectan durante el proceso de autolisis. Como se ha demostrado previamente que las manoproteínas presentes en la pared celular de las levaduras podrían estar implicadas en la eliminación de toxinas de orígen fúngico17 y están relacionadas con otros procesos que involucran mecanismos de adsorción,18 llevamos a cabo un análisis del comportamiento de la fracción de manoproteínas parietales durante la autolisis de las levaduras.
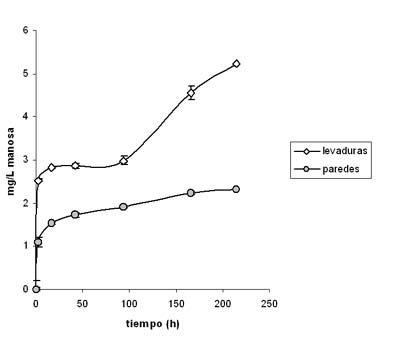
En la figura 2 se representan los resultados obtenidos del análisis de la manosa presente en el medio vínico en las diferentes etapas de la autolisis, tanto para las levaduras como las paredes celulares de las mismas. Como se puede observar en los experimentos realizados con levaduras, la mayor disminución en la capacidad de adsorción de la OTA coincide en el tiempo con un incremento casi exponencial de la concentración de manosa en el medio vínico (166 h y 214 h). Estos resultados demuestran la implicación de las manoproteínas parietales en la adsorción de la OTA, y cómo este proceso se ve afectado con la hidrólisis de las mismas durante la autolisis de las levaduras. En cambio, el comportamiento observado con la autolisis de las paredes de las mismas fue diferente y la cantidad de manosa liberada significativamente menor (p < 0,05), lo que podría interpretarse como que en el proceso de obtención de las paredes celulares se ha eliminado una gran parte de los enzimas hidrolíticos que participan en la autolisis. Este hecho se traduce en una capacidad de adsorción relativamente constante por parte de las paredes, a diferencia de las lías de levadura.
El tratamiento térmico previo de las levaduras (85 ºC, 10 min), permitió que tanto las levaduras como las paredes aumentasen su capacidad de retención de OTA, que alcanzó en el caso de las paredes hasta un 95% de retención de OTA.3 Además, levaduras y paredes de las mismas mantuvieron su capacidad de adherencia durante todo el experimento, probablemente debido al daño térmico de la batería enzimática que participa en los procesos de degradación autolítica. Aunque las causas de este comportamiento no se han estudiado, es probable que el tratamiento térmico aumentara los sitios disponibles sobre la pared celular para la adsorción de la OTA, incrementando de esta forma la eficiencia del proceso de descontaminación.
Conclusiones
La pared celular de las levaduras, debido muy en particular a las manoproteínas constituyentes de la misma, participan de forma activa en la eliminación de la OTA del medio vínico utilizado a través de mecanismos de adsorción. La degradación enzimática que tiene lugar durante la autolisis afecta de forma significativa la capacidad de adsorción de la toxina por parte de las levaduras. Probablemente tanto la inactivación de estos enzimas hidrolíticos por calor, como los cambios que el mismo produce en la estructura de los componentes de la pared, permiten incrementar la capacidad de adsorción de dicha sustancia tóxica por las levaduras y paredes, aumentando así el proceso de descontaminación de la OTA. El uso de paredes celulares en lugar de las levaduras permite obtener una capacidad de adsorción más constante que se afecta menos por la autolisis.
A día de hoy, cuando los estudios de procedimientos de eliminación de OTA en vino continúan realizándose, no parece existir una solución mejor para el mismo que la aplicación del APPCC, ya que es la que asegura en mayor grado que no va a procesarse uva contaminada con OTA.
Agradecimientos
Los autores de este artículo cuentan con financiación pública en los proyectos PIE 2006701188, AGL2006-02558; CONSOLIDER INGENIO 2010 CSD2007-00063FUN-C-FOOD (Ministerio de Educacion y Ciencia) y ALIBIRD-CM S-0505/AGR-0153 (Comunidad Autónoma de Madrid) (), merced a los cuales desarrollan actividades de investigación científica transferibles a empresas del sector. Los interesados pueden obtener más información en la web o contactando directamente con los autores.
Bibliografía
- Núñez YP, Carrascosa, AV, González R, Polo MC y Martínez-Rodríguez A. J. Agric Food Chem 2006, 54: 7898-7903
- Carrascosa, AV. Sem Vitivinicol 2008, 3246: 3318-3321.
- Núñez YP, Pueyo E, Carrascosa AV y Martínez-Rodríguez A. J Food Protect 2008, 71: 1496-1499.
- OIV. CST1/2002 adoptada en 2002 por los estados miembros de la OIV en ocasión de la Asamblea General de Bratislava. Eslovaquia, 2002.
- UE. Reglamento (CE) Nº 123/ 2005 de la Comisión del 26 de enero de 2005 por el que se modifica el Reglamento (CE) Nº 466/ 2001 con respecto a la Ocratoxina A. Diario Oficial de la Unión Europea, L 25, 2005.
- Carrascosa AV. «APPCC para la elaboración del vino: ocratoxina A». En: Microbiologia del vino. Coord. R. Muñoz, R. Gonzalez y A.V. Carrascosa. Ed. AMV, 2005, Madrid.
- Martínez-Rodríguez AJ y Carrascosa AV. Sem Vitivinicol 2007, 3152,: 4042-4044.
- Martínez-Rodríguez AJ y Carrascosa AV. ACE Rev Enol 2007, 78: 3-4 (www.acenologia.com/dossier78).
- Martínez-Rodríguez AJ y Carrascosa AV. ACE Rev Enol 2007, 78: 28-2-07, 5-12 (www.acenologia.com/dossier78).
- Martínez-Rodríguez AJ y Carrascosa AV. Food Control 2009, 20: 469-475.
- Directiva 2002/32/EC Official Journal L 140, 10-22.
- Bejaoui H, Mathieu F, Taillandier P, Lebrihi AJ. Appl Microbiol 2004, 97: 1038-1044.
- Moruno EG, Sanlorenzo C, Boccaccino B, Di Stefano R. Am J. Enol Vitic 2005, 56 : 73-76.
- Caridi A, Galvano F, Tafuri A, Ritieni A. Enzyme Microb Tech 2006, 40 : 122-126.
- Del Prete V, Rodríguez H, Carrascosa AV, De las Rivas B, García-Moruno E. y Muñoz R. Sem Vitivinicol 2007, 3192: 3382-3387.
- Del Prete V, Rodríguez H, Carrascosa AV, De las Rivas B, García-Moruno E. y Muñoz R. J. Food. Protect. 2007, 9: 2155-2160.
- Shetty PH, Jespersen L. Trends Food Sci Tech 2006, 17: 48-55.
- Line JE, Bailey JS, Cox NA, Stern NJ, Tompkins T. Poultry Sci 1998, 77: 405-410.