Introducción
Un enturbiamiento que aparece en una botella de vino blanco se percibe indiscutiblemente como un defecto y deprecia la imagen global que el consumidor conservará de un vino. Por lo tanto, en general se considera esencial garantizar la estabilidad de la claridad de un vino después del embotellado, durante el transporte y durante todo el almacenamiento del vino, incluso durante las olas de calor, cada vez más frecuentes y que se dan en todos los continentes.
En los últimos 60 años se han realizado muchos estudios científicos dedicados a la estimación del riesgo de quiebra proteica (RQP), y muchos de estos estudios tratan sobre cómo tratar la quiebra proteica. En otras palabras, puesto que son esencialmente las proteínas las que causan el enturbiamiento, ¿cómo podemos actuar sobre ellas?
Bentonitas y posibles alternativas técnicas
A nivel internacional, el tratamiento con bentonita sigue siendo la referencia para eliminar las proteínas (responsables del enturbiamiento de un vino blanco) cuando todavía están en estado soluble. Sin embargo, el tratamiento con bentonita puede afectar al color, incidir en la calidad aromática o reducir la espumabilidad de un vino base destinado a ser espumoso, pero también generar un volumen importante de lías. Por estas razones, muchos elaboradores buscan alternativas tecnológicas a la bentonita. Entre estas alternativas, podemos mencionar:
– Tratamiento térmico del mosto o del vino (llamado cracking o pasteurización flash cuando dura unos minutos, pero que puede durar hasta 16 horas a más de 60 °C) para inducir, en el depósito, la floculación de las proteínas termoinestables. El cracking se utilizó inicialmente para tratar las uvas afectadas por Botrytis y/o con altos niveles de geosmina (Guérin, 2013).
– El uso de proteasas capaces de degradar las proteínas nativas de la uva, combinando un tratamiento térmico de 1-2 h a 50 °C con un paso de 1 minuto a 70 °C (Pocock et al., 2003; Marangon et al., 2012; Marchal et al., 2020).
– El uso de macromoléculas como las manoproteínas de Saccharomyces cerevisiae (Moine-Ledoux y Dubourdieu, 1999; Dupin et al., 2000) o las galactomanoproteínas de Schizosaccharomyces japonicus (Millarini et al., 2020), el quitosano (Colangelo et al., 2018) o los carragenatos (Ratnayake et al., 2019) que modifican el entorno coloidal del vino para prohibir que las proteínas formen flóculos visibles a simple vista.
– Eliminación de proteínas del vino mediante nuevos adsorbentes como los óxidos de circonio (Salazar et al., 2006; Marangon et al., 2010; Lucchetta et al., 2013) o las nanopartículas cargadas (Mierczynska-Vasilev et al., 2017).
A pesar de los resultados alentadores de la mayoría de los enfoques mencionados, en muchas situaciones la solución técnica propuesta no es totalmente satisfactoria. En otras palabras, las alternativas técnicas propuestas reducen significativamente el RQP de los vinos tratados (o de los vinos elaborados a partir de mostos tratados), pero no lo suficiente como para considerar que el vino será coloidalmente estable.
Estas conclusiones pueden deberse al hecho de que, en todos estos experimentos enológicos realizados en la bodega o a escala de laboratorio, el RQP se estima sistemáticamente mediante una prueba de calor en la que el vino se calienta a 80 °C durante 30 minutos a 2 horas.
Estas condiciones están muy alejadas de las temperaturas a las que puede estar sometido un vino, incluso en condiciones de ola de calor, que en los últimos años hemos visto que son cada vez más frecuentes, más largas en número de días y con temperaturas que marcan constantemente nuevos récords.
Esta importante diferencia de temperatura entre las pruebas de calor realizadas en el laboratorio y la realidad (incluidas las olas de calor) que puede encontrar un vino blanco nos ha llevado a reconsiderar la pertinencia de esta prueba de 80 °C que, sin embargo, se utiliza a nivel internacional. Este planteamiento coincide también con las numerosas observaciones que los productores de vino y los laboratorios de enología nos comunican desde hace años y que pueden resumirse como sigue:
– La prueba de 80 °C sobreestima el RQP.
– La prueba de los 80 °C da resultados positivos (turbidez) con vinos que, según la experiencia de los enólogos, nunca presentan quiebra proteica después del embotellado.
Estas observaciones coinciden plenamente con un estudio de Meistermann (2010) realizado en una red de laboratorios en Francia y que incluye varios cientos de muestras. Los resultados de este estudio en 6 variedades de uva muestran que las turbideces observadas después de calentar los vinos durante 30 minutos a 80 °C son estadísticamente más altas (o considerablemente más altas) que las observadas para los mismos vinos después de pasar 2 meses a 35 °C.
Frente a estos resultados, constatados en varias regiones vitícolas francesas, pero también en otros países, realizamos un estudio para comprender mejor las posibles relaciones entre la turbidez estimada por diversas pruebas térmicas y la turbidez que aparece tras un episodio de ola de calor. Como la realidad de las olas de calor es diversa, en función de las regiones y de las condiciones meteorológicas del año, sometimos los vinos de este estudio a diferentes condiciones térmicas para cubrir un campo suficientemente amplio.
En estudios anteriores, se eligió una prueba a 35 °C para simular la temperatura que puede alcanzar un vino en verano: 10 días a 35 °C (Dubourdieu et al., 1988), 2 meses a 35 °C (Meistermann, 2010), 2 semanas a 35 °C (Vernhet et al., 2020). Dadas las temperaturas observadas en 2020, hemos optado por realizar pruebas de olas de calor a 38, 42 y 46 °C, cuya duración se mide en días. La prueba a 80 °C se realiza en unas decenas de minutos. Para acercarse lo más posible a esta práctica actual, que permite disponer de los resultados en pocas horas, los vinos también se sometieron a pruebas a 50 °C durante períodos cortos (de 10 a 90 minutos). Esta temperatura se aproxima a la prueba de 55 °C utilizada en un estudio publicado hace casi 20 años (Marchal et al., 2002), que ya suponía una desviación significativa de la prueba de referencia a 80 °C.
Vinos en el estudio
Los resultados de los ensayos que realizamos durante las campañas 2018, 2019 y 2020 se resumen en este artículo a partir de tres ejemplos representativos de dos regiones vinícolas (Touraine – Valle de Loira y Auxerrois – norte de Borgoña). Los vinos estudiados se elaboran a partir de uvas o mostos cedidos amablemente por Les Vignerons des Coteaux Romanais en Saint-Romain-sur-Cher (AOP Touraine) – Sauvignon blanc 2020, y por las Caves Bailly Lapierre en Saint-Bris-le-Vineux (AOP Saint-Bris) – Sauvignon blanc 2020.
Mostos: ningún tratamiento, excepto el sulfitado a 6 g/hL. Inoculación con levadura COI 18-2007 a 20 g/hL después de rehidratación/multiplicación durante 30 min en el mosto diluido al 50% con agua tibia del grifo para obtener 30-32 °C. Suplementación con 10 g/hL de fosfato diamónico. Fermentación alcohólica (FA) en garrafas de vidrio de 5 litros.
Vinos: trasiego al final de la FA y sulfitado con 8 g/hL de SO2 para evitar la fermentación maloláctica (FML). Almacenada durante 4 semanas a 18 °C, colocada en una cámara frigorífica a 4 °C durante 2 semanas, luego centrifugada (5 minutos a 17 000 g) y almacenada durante 2 semanas en una bodega a 15 °C antes de evaluar el RQP mediante varias pruebas de calor.
Se anotarán estos 3 vinos: Sv-Loira 1, Sv-Loira 2 (vino para el tratamiento con bentonita), Sv-Saint Bris.
Quiebra coloidal y riesgo de quiebra proteica (RQP)
Todos los vinos se filtran con membranas de corte de 0,45 µm antes de las 20 pruebas de calor. Se realizan tres condiciones para cada uno de los 4 vinos:
– Calentamiento a 80 °C durante 10, 20, 30, 45 y 60 minutos, es decir, 5 pruebas a 80 °C.
– Calentamiento a 50 °C durante 10, 20, 30, 45, 60 y 90 minutos, es decir, 6 pruebas a 50 °C.
– Condiciones de temperatura canícula y ola de calor (9 modalidades):
– 1 día a 38 °C
– 4 días a 38 °C
– 1 día a 42 °C
– 4 días a 38 °C + 1 día a 42 °C
– 4 días a 42 °C
– 4 días a 38 °C + 4 días a 42 °C
– 4 días a 46 °C
– 4 días a 42°C + 4 días a 46°C
– 4 días a 38°C + 4 días a 42°C + 4 días a 46°C
Para todas estas 20 pruebas, los vinos filtrados y estériles se colocan en tubos de microbiología de vidrio (15 mL de vino/tubo) herméticamente cerrados con tapones equipados con un sello para evitar cualquier pérdida de líquido. Las 20 condiciones de calentamiento se analizan por triplicado para todos los vinos.
Para las condiciones de calor, los vinos se colocaron en una cámara de cultivo a 38, 42 o 46 °C con regulación de temperatura a ±0,5 °C. Para las pruebas a 50 y 80 °C, los tubos se colocaron en rejillas metálicas escalonadas para permitir la circulación del líquido y se sumergieron en el baño de agua con control termostático y regulación de la temperatura a ±0,1 °C.
Al final del tratamiento térmico, los vinos se dejan a temperatura de laboratorio hasta el día siguiente. Las turbideces se miden con un turbidímetro portátil HANNA que cubre el rango de 0,1 a 750 NTU. Antes de medir la turbidez, los tubos se invierten 3 veces para resuspender el depósito floculado. Cada valor indicado en los siguientes histogramas es la media de 3 medidas.
Tratamiento con bentonita
El vino Sauvignon de Touraine Sv-Loira 2 fue, además del control, tratado con una bentonita cálcica activada (IOC – Bentostab) previamente hidratada con agua durante 4h (tratamiento en botellas de vidrio de 37,5 cL). Las dosis de bentonita fueron de 10, 20, 30 y 40 g/hL. Después de 2 días a temperatura ambiente, los vinos fueron centrifugados y filtrados (en las mismas condiciones que los vinos de control no tratados).
RQP de Sauvignon de Saint-Bris (Figura 1)
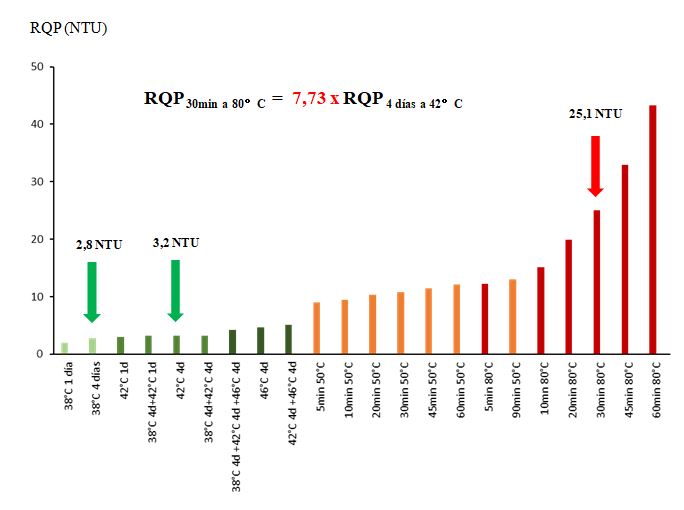
Las pruebas de ola de calor muestran un RQP que no superan los 3,2 NTU a 42 °C, incluso cuando el vino pasó 4 días a 38 °C + 4 días a 42 °C. Estas condiciones, que pueden considerarse muy excepcionales para una botella de vino blanco, generan una turbidez que no será perceptible a simple vista. Después de 4 días a 46 °C o 4 días a 42 °C + 4 días a 46 °C, la turbidez es de alrededor de 5 NTU y la comparación visual con el Control no calentado permitió a los jueces diferenciar los vinos durante la prueba triangular (servicio en copas INAO). Algunos jueces observaron que el vino calentado tenía menos brillo o parecía un poco turbio. Sin embargo, estas condiciones de temperatura, nunca alcanzadas, que sepamos, en Europa, no reflejan (o todavía no lo hacen) una realidad y las pruebas de calor a 42 °C, o incluso a 38 °C (2,8 NTU), parecen ser puntos de comparación más relevantes para juzgar la necesidad de un tratamiento de estabilización coloidal.
Sauvignon – St Bris-Le-Vineux (Yonne) – Vendimia 2020 – AOC Saint Bris
En este caso, el vino puede considerarse estable, sin riesgo de quiebra coloidal en la gran mayoría de los casos en los que será transportado o almacenado.
Cuando el vino se somete a una temperatura de 50 °C, se observa que la turbidez aumenta significativamente, incluso para un tiempo de calentamiento de 30 min donde alcanza 10,8 NTU. Este valor es el doble del observado en las condiciones de calor más extremas. Cuando el vino se calentó durante 60 y 90 minutos a 50 °C, la turbidez fue de 12,2 y 13,0 NTU respectivamente el día después del calentamiento.
Podemos ver que calentar el vino a “sólo” 50 °C produce una turbidez que ya no refleja la realidad de la ola de calor a la que puede estar sometida una botella de vino blanco (38-42 °C).
El término “sólo” indica que la temperatura de 50 °C está lejos de la prueba de 80 °C, que es capaz de producir niveles de turbidez mucho más altos. En efecto, tras un calentamiento de 30 minutos a 80 °C, el vino presentaba una turbidez de 25,1 NTU, que es globalmente el doble de la generada por una prueba de 60 minutos a 50 °C (12,2 NTU).
Si ahora comparamos la prueba más utilizada para predecir el riesgo de quiebra proteica (30 minutos a 80 °C) con condiciones de ola de calor muy excepcionales (4 días a 42 °C), vemos que la turbidez se sobreestima en un factor cercano a 8.
En concreto, esto significa, según la prueba utilizada, que este vino Sauvignon es 1) coloidalmente estable (prueba de la ola de calor), 2) ligeramente inestable (prueba a 50 °C), o 3) francamente inestable (prueba a 80 °C). En función de estos tres diagnósticos, el vino: 1) no necesitará tratamiento con bentonita, 2) necesitará una dosis muy baja de bentonita, o 3) necesitará una dosis más alta de bentonita (dar una dosis de bentonita, en g/hL, no tiene sentido en términos absolutos; depende de la actividad del producto enológico). Esta situación no es satisfactoria ni cómoda para los elaboradores.
RQP del Sauvignon-1 del Valle de Loira (Sv-Loira 1, Figura 2)
Las pruebas de calor muestran que el RQP alcanzan 7,2 NTU después de 4 días a 42 °C, e incluso 15 NTU después de 4 días a 46 °C. Estos niveles de turbidez, aunque solo se encontrarán muy excepcionalmente en este vino, son perceptibles por un consumidor. En estas condiciones de calentamiento, este vino de Sauvignon puede considerarse ligeramente inestable en términos de proteínas (tras 4 días a 38 °C, la turbidez era de 5,7 NTU). Calentando el vino durante 30 min a 50 °C, la turbidez alcanza 20 NTU, e incluso 27,1 NTU si se mantiene el calentamiento durante 90 min. En comparación con la prueba de 4 días a 42 °C, la turbidez ya se multiplica por un factor cercano a 4 (27,1 / 7,2 = 3,8).
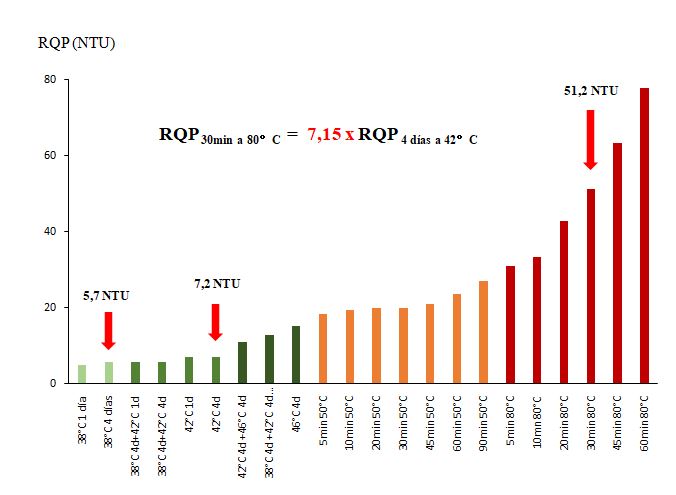
Sauvignon (Sv-Loira 1) – Vendimia 2020 – AOC Touraine
La prueba a 80 °C durante 30 minutos. (51,2 NTU) sigue multiplicando el RQP por 2 en comparación con la prueba a 50 °C durante 90 minutos, ya considerada excesiva. Al final, el RQP estimado del vino tras el calentamiento a 80 °C durante 30 minutos es 7 veces superior al RQP observado después de una ola de calor a 42 °C.
A diferencia del Sauvignon de Borgoña (Auxerrois) (Figura 1), este vino puede considerarse ligeramente inestable. Pero, una vez más, observamos valores muy diferentes del RQP según las pruebas térmicas realizadas, con saltos considerables entre 42 y 50 °C, así como entre 50 y 80 °C.
Se pueden comparar estos saltos cualitativos con el comportamiento de las proteínas de la clara de huevo. Este ejemplo es interesante porque todo el mundo ha observado ya las diferentes texturas del huevo en función del proceso de cocción aplicado. Los numerosos estudios publicados sobre el comportamiento de las proteínas del huevo sometidas a diversos tratamientos térmicos muestran las temperaturas críticas correspondientes al paso de las proteínas de un estado soluble a uno insoluble. En cuanto a las proteínas del vino, el tiempo durante el cual se aplica una determinada temperatura es también un parámetro de importancia primordial.
Si el vino se calienta durante 30 minutos a 80 °C, el aumento de la temperatura provoca la insolubilización de las proteínas más termoestables, como la invertasa de la uva presente en el vino (Marchal et al., 2020; Dufrechou et al., 2010). Con la prueba de 30 minutos a 80 °C, las proteínas que nunca se insolubilizarán en una botella de vino blanco, incluso cuando se almacenen en condiciones de calor extremo, participarán en la turbidez. Este segundo ejemplo muestra, una vez más, el carácter irreal de la prueba de calor a 80 °C.
RQP del Sauvignon-2 del Valle de Loira (Sv-Loira 2, Figura 3)
Las pruebas de calor muestran que el RQP alcanza 4,1 NTU después de 4 días a 42 °C, y solo 3 NTU después de 4 días a 38 °C. Este vino, al igual que el Sauvignon de Saint-Bris (Figura 1), puede considerarse coloidalmente estable.
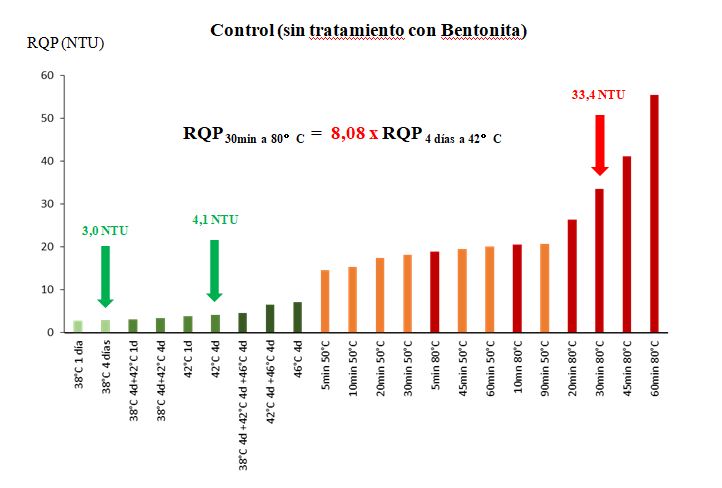
Sauvignon (Sv-Loira 2) – Vendimia 2020 – AOC Touraine
Se observa un fuerte aumento de la turbidez cuando el vino se calienta a 50 °C, incluso durante 10 minutos de calentamiento. A 50 °C, podemos ver que la nubosidad varía solo ligeramente entre 30 y 90 minutos de calentamiento. Esto indica de nuevo que se ha alcanzado una temperatura crítica para la insolubilización de determinadas proteínas del vino, principalmente de origen vegetal (de la uva). Para insolubilizar otros tipos de proteínas, hay que aumentar la temperatura de calentamiento del vino. Esto es lo que se observa al pasar a 80 °C; las proteínas más termoestables acaban sin embargo por flocular, como la invertasa de la uva. A 80 °C, la turbidez alcanza 33,4 y 55,4 NTU tras 30 y 60 minutos de calentamiento, respectivamente. Sin embargo, estos valores no tienen sentido, ya que nunca se alcanzarán las condiciones de temperatura (80 °C) que permiten la insolubilización de las proteínas más termoestables de un vino de Sauvignon.
RQP y tratamiento con bentonita (Figura 4)
El vino de Sauvignon del Valle de Loira (Sv-Loira 2), que en función de la prueba de calor realizada podía considerarse estable o, por el contrario, inestable a nivel coloidal (vino de control, figura 3), fue tratado con dosis de bentonita que iban de 10 a 40 g/hL. Estos 4 vinos clarificados fueron sometidos igualmente a 20 pruebas de calor, por triplicado. En cuanto al vino Control sin tratamiento (Figura 3), observamos diferencias muy fuertes en cuanto a la turbidez entre una prueba de calor de 4 días a 42 °C y la prueba de calor de 30 minutos a 80 °C. Podemos ver en los gráficos que la escala de turbidez disminuye a medida que aumenta la dosis de bentonita utilizada. Así, la escala de turbidez disminuye de 60 NTU para el vino Control (Figura 3), a 45, 25, 12 y 5 NTU (Figuras 4) cuando las dosis de bentonita son respectivamente de 10, 20, 30 y 40 g/hL de vino.
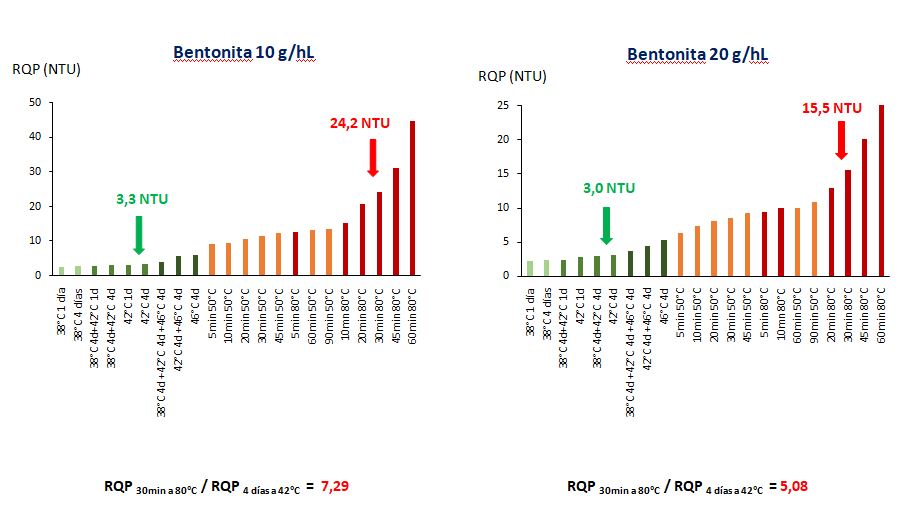
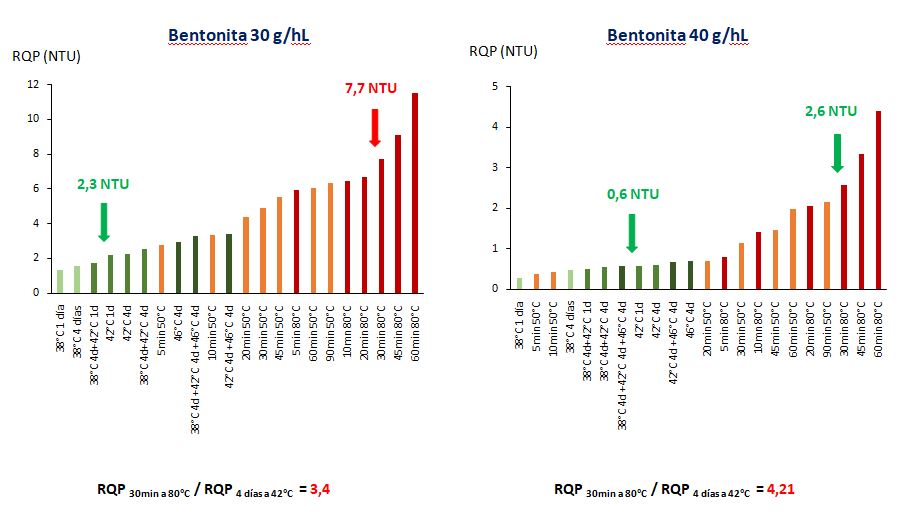
Esta disminución de la turbidez observada en los vinos clarificados se corresponde, como era de esperar, con un agotamiento creciente del contenido proteico total del vino. Para cada dosis de bentonita, se indica la relación RQP 30min a 80°C / RQP4 días a 42°C. Disminuye gradualmente de 8,08 para el vino Control a 3,4 para el vino clarificado con 30 g/hL de bentonita. Esto significa que incluso para un vino fuertemente empobrecido en proteínas termoinestables, la prueba a 80 °C sigue dando una turbidez no despreciable porque esta temperatura insolubiliza las proteínas como la invertasa que son: 1) menos adsorbidas por las partículas de arcilla que las proteínas que participan en la quiebra proteica (Vernhet et al., 2020) y 2) mucho más termoestables que las proteínas de tipo taumatina o las quitinasas presentes en el vino (Marchal et al., 2020).
En los cuatro gráficos de la figura 4, las flechas verdes indican vinos estables y las rojas, vinos inestables respecto a la insolubilizacion de proteínas. Con la prueba de 30 minutos a 80 °C, el vino pasa progresivamente de 33,4 NTU (control sin tratamiento con bentonita, figura 3) a 24,2, 15,5, 7,7 y 2,6 NTU cuando se aumenta la dosis de bentonita utilizada de 10 a 40 g/hL. Es decir, con la prueba a 80 °C, el vino se considera estable solo después de la clarificación con esta bentonita a 40 g/hL. En condiciones de calor (4 días a 38 °C o 4 días a 42 °C), este vino sin tratamiento presenta una turbidez poco o nada perceptible al ojo humano, por lo que puede considerarse sin riesgo de quiebra proteica.
Los resultados de las figuras 3 y 4 muestran que la elección de la dosis de bentonita dependerá claramente del ensayo térmico utilizado: se puede evitar el tratamiento con bentonita o utilizar una dosis que oscile entre 10 y 40 g/hL, en función del ensayo térmico realizado en el laboratorio.
Conclusiones
Los vinos de Sauvignon (Valle de Loira y Auxerrois) presentados en este estudio fueron sometidos a pruebas de calor que iban de 38 °C (olas de calor) a 80 °C (la prueba de laboratorio más utilizada en todo el mundo). Para estos tres vinos, podemos ver que la sobreestimación del RQP oscila entre un factor de 4 y un factor de 8 en general.
La prueba a 50 °C, con un calentamiento mantenido de 30 a 90 minutos, da resultados mucho más cercanos a la ola de calor a la que puede someterse una botella de vino blanco. No obstante, las turbideces observadas por esta prueba siguen mostrando una sobreestimación del RQP, que puede considerarse como un margen de seguridad para los vinos sometidos a condiciones extremas.
Esta prueba a 50 °C, que evidentemente es mucho más adecuada para estimar el RQP de un vino blanco que la prueba de los 80 °C, debería sin embargo aplicarse con una gama más amplia de vinos, para tener en cuenta el efecto de la variedad de uva, las condiciones de la meteorología del año, las prácticas de vinificación o la región de producción de la uva.
Este estudio, dedicado a la comparación entre las pruebas térmicas de laboratorio y las realidades de las olas de calor (que han sido tratadas de forma plural), muestra también que una estimación realista del RQP de un vino permite la aplicación de un tratamiento enológico adaptado y realista. Para muchos vinos, esto significa claramente una reducción, o incluso una eliminación, de la cantidad de bentonita utilizada para la estabilización coloidal, cuando ésta existe realmente.
También significa la posibilidad de reconsiderar o desarrollar alternativas técnicas (presentadas al principio de este artículo) que se consideran insuficientes si nos referimos a la prueba de 80 °C, pero bastante eficaces si nos basamos en una prueba a 50 °C.
Referencias bibliográficas
Colangelo, D., Torchio, F., De Faveri, D.M., Milena, L. “The use of chitosan as alternative to bentonite for wine fining: Efects on heat-stability, proteins, organic acids, colour, and volatile compounds in an aromatic white wine. Food Chem. 2018, 264, 301-309.
Dubourdieu D., Serrano D., Vannier A-C., Ribéreau-Gayon P. “Étude comparée des tests de stabilité protéique”. Connaissance Vigne Vin, 1988, 22, 261-273.
Dufrechou M, Sauvage F-X, Bach B, Vernhet A. “Protein aggregation in white wines: influence of the temperature on aggregation kinetics and mechanisms”. J. Agric. Food Chem, 2010, 58, 10209-10218.
Dupin, I.V., McKinnon, B.M., Ryan, C., Boulay, M., Markides, A.J., Jones, G.P., Williams, P.J., Waters, E. “Saccharomyces cerevisiae mannoproteins that protect wine from protein haze: Their release during fermentation and lees contact and a proposal for theirmechanismof action”. J. Agric. Food Chem. 2000, 48, 3098-3105.
Falconer R.J., Marangon M., Van Sluyter SC., Neilson K.A., Chan C. Waters E.J: “Thermal stability of thaumatin-like protein, chitinase and invertase isolated from Sauvignon Blanc and Semillon juice, and their role in haze formation in wine”. J. Agric. Food Chem., 2010, 58, 975-980.
Guérin L. “Intérêts de la thermovinification appliquée aux cépages et/ou raisins blancs. Colloque viticole et œnologique. Les vins blancs de la Loire : Marché, optimisation aromatique et itinéraires d’élaboration”. SIVAL – Angers, Janvier 2013.
Lucchetta M., Pocock K.F., Waters E., Marangon M. “Use of Zirconium Dioxide during Fermentation as an Alternative to Protein Fining with Bentonite for White Wines”. Am. J. Enol. Vitic. 2013, 64, 400-404.
Marangon M., Lucchetta M., Waters, E. “Protein stabilization of white wines using zirconium dioxide enclosed in a metallic cage”. Aust. J. Grape Wine Res. 2010, 17, 28-35.
Marangon M., Van Sluyter S.C., Robinson E.M.C., Muhlack R.A., Holt H.E., Haynes P.A., Godden P.W., Smith P.A. Waters E.J. (2012), “Degradation of white wine haze proteins by Aspergillopepsin I and II during juice flash pasteurization”. Food Chem, 135, 1157-1165.
Marchal R., Gaillet M., Salmon T., Guillaume A., Lallement A., Coutel Y. “Utilisation des protéases d’Aspergillus pour traiter la casse colloïdale des vins blancs”. Revue des Œnologues, 2020, 176, 35-39.
Marchal R., Salmon T., Guillaume A., Coutel Y. “Removal of white wine heat unstable proteins by using proteases and flash pasteurization. Comparison with bentonites treatments. 11th International symposium of Enology (Œno2019) – 11th edition of In Vino Analytica Scientia symposium (IVAS 2019)”, June 25-28, 2019, Bordeaux, France.
Marchal R., Weingartner S., Voisin C., Jeandet P., Chatelain F. (2002). “Utilisation de modèles mathématiques pour optimiser les doses de bentonite gonflée et non gonflée lors du collage des vins blancs. Partie I: Clarification et stabilisation colloïdale”. J. Int. Sciences Vigne Vin, 36, 169-176.
Meistermann E. “Stabilisation protéique des vins blancs et rosés”. www.infowine.com. Revue internet de viticulture et œnologie, 2010, 10/2.
Mierczynska-Vasilev A., Boyer P., Vasilev K., Smith P.A. “A novel technology for the rapid, selective, magnetic removal of pathogenesis-related proteins from wines”. Food Chemistry, 2017, 232, 508–514.
Millarini V., Ignesti S., Cappelli S., Ferraro G., Adessi A., Zanoni B., Fratini E., Domizio P. (2020). “Protection of Wine from Protein Haze Using Schizosaccharomyces japonicus Polysaccharides. Foods, 9, 1407; doi:10.3390/foods9101407.
Moine-Ledoux, V., Dubourdieu, D. “An invertase fragment responsible for improving the protein stability of dry white wines.” J. Sci. Food Agric. 1999, 79, 537-543.
Pocock KF., Høj PB., Adams KS., Kwiatkowski MJ., Waters EJ. (2003), “Combined heat and proteolytic enzyme treatment of white wines reduce haze forming protein content without detrimental effect”. Aus J. Grape Wine Res, 9, 56-63.
Ratnayake S., Stockdale V., Grafton S., Munro P., Robinson A.L., Pearson W., McRae J.M., Bacic A. “Carrageenans as heat stabilisers of white wine”. Australian Journal of Grape and Wine Research, 2019, 25, 439-450.
Salazar, F.N., Achaerandio, I., Labbé, M.A.; Güell, C., López, F. “Comparative study of protein stabilization in white wine using zirconia and bentonite: Physiochemical and wine sensory analysis”. J. Agric. Food Chem. 2006, 54, 9955-9958.
Vernhet A., Meistermann E., Cottereau P., Charrier P., Chemardin P., Poncet-Legrand C. (2020). “Wine Thermosensitive Proteins Adsorb First and Better on Bentonite during Fining: Practical Implications and Proposition of Alternative Heat Tests”. J. Agric. Food Chem., 68, 13450-13458.