Introducción
El mosto de uva, como ecosistema en el que ha de producirse la fermentación alcohólica, es un medio bastante agresivo para los microorganismos. Se caracteriza por una alta concentración de azúcares (que generan estrés osmótico), bajo pH, y presencia limitada de nitrógeno y vitaminas. Todo ello, junto con el uso del sulfitado hace que solo aquellos microorganismos mejor adaptados a estas condiciones sean los que se impongan durante la fermentación. Entre la amplia biodiversidad de microorganismos presente en la superficie de la uva antes del prensado, Saccharomyces cerevisiae es la levadura con mecanismos mejor adaptados para competir e imponerse durante la fermentación. Estos mecanismos han sido adquiridos y optimizados a lo largo del proceso de domesticación llevado a cabo de forma involuntaria por el ser humano.
Estas adaptaciones propias de los entornos enológicos no están presentes de la misma manera en todas las cepas de S. cerevisiae. El clado formado por las cepas vínicas representa solo una pequeña parte de toda la biodiversidad de cepas que se han adaptado a ambientes humanos y procesos industriales como pueden ser la elaboración de cerveza o sake y las cepas aisladas de medios naturales (Fig. 1). Aun así, forma un conjunto de cepas bien definido por sus características genéticas (Peter et al. 2018).
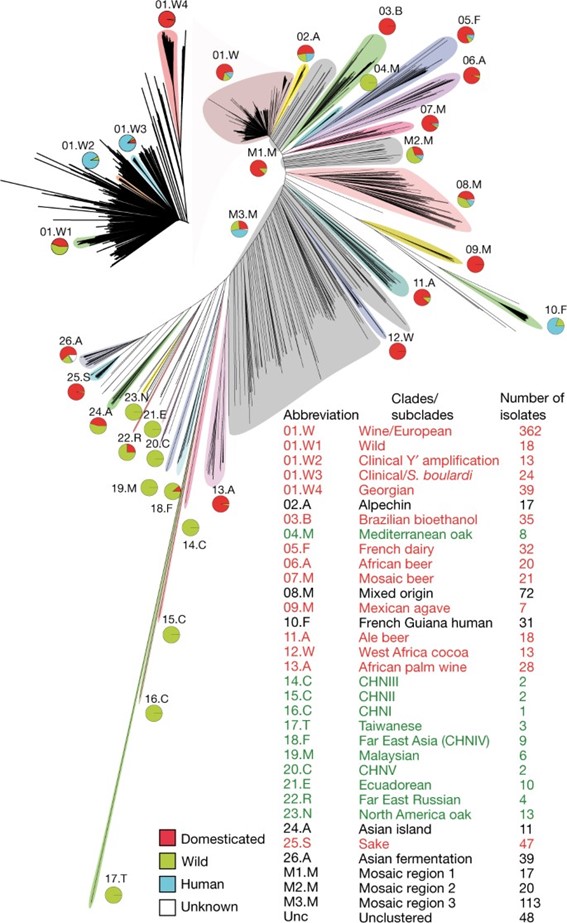
FIgura 1 Clados de Saccharomyces cerevisiae identificados en Peter et al., 2018. Se identifcaron un total de 26 clados. El clado 01.W corresponde a las cepas vínicas identificadas en Europa
Algunas de las adaptaciones para soportar el estrés osmótico son la sobreproducción de glicerol y una cascada de MAP kinasas específica, la ruta HOG. Estas adaptaciones no son las únicas necesarias para soportar el estrés osmótico, sino que forman parte de mecanismos de control más amplios, al igual que la tolerancia a altas concentraciones de etanol o temperaturas extremas. Para responder de forma coordinada a estas fuentes de estrés, en S. cerevisiae se han descrito dos mecanismos de respuesta generales, el ESR (Environmental Stress Response) y el FSR (Fermentation Stress Response). Se trata de cascadas de respuestas al estrés que a su vez comparten hasta un 20% de los genes implicados. Estas adaptaciones y mecanismos de respuesta no son exclusivos de las cepas vínicas de S. cerevisiae, tampoco de la especie o el género, pero sí se trata de las cepas más eficaces a la hora de responder a estos estímulos (Gonzalez y Morales 2022).
Esta eficacia es la que permite a S. cerevisiae imponerse en un ambiente en el que, en un primer momento, se trata de una especie minoritaria. La mayoría de microbiota presente en las uvas no sobrevivirá a las primeras horas de fermentación. Algunos géneros de ascomicetos como Hanseniaspora, Torulaspora, Metschnikowia, Starmerella, Candida o Pichia estarán presentes durante un mayor número de horas y contribuirán a la fermentación junto a S. cerevisiae. Finalmente, y gracias a las adaptaciones descritas, S. cerevisiae se impondrá y finalizará la fermentación.
En este artículo se revisarán las características genéticas que permiten a S. cerevisiae imponerse en este ecosistema y finalizar la fermentación.
Evolución del genoma de S. cerevisiae
Durante su evolución, el genoma de S. cerevisiae se ha modificado constantemente. Entre estas modificaciones, destaca la duplicación del genoma (WGD por sus siglas en inglés) (Wolfe y Shields 1997). Este evento, que consiste en que todo el genoma de un ancestro común de Saccharomyces y otros géneros de levaduras se duplicó para dar lugar a una célula tetraploide, ocurrió aproximadamente hace 100 millones de años. Tras la duplicación se produjo una pérdida de muchos de los genes duplicados y una reordenación cromosómica, conservando hasta un 13% de los genes duplicados (Wolfe y Shields 1997). Entre los efectos más relevantes de esta duplicación se observa un flujo glucolítico aumentado gracias a la conservación de copias duplicadas de genes relacionados con la glicolisis. Un ejemplo de esta duplicación son los genes ADH1 y ADH2, los cuales contribuyen a un uso más eficiente de la glucosa como fuente de carbono durante la fermentación y la utilización del etanol como fuente de carbono (crecimiento diaúxico) (Belda et al. 2019; Conant y Wolfe 2007).
La duplicación del genoma también permitió la aparición de la estrategia MAC (make-accumulate-consume) la cual implica el aumento del flujo glicolítico, el efecto Crabtree y el crecimiento diaúxico (Belda et al. 2019; Piskur et al. 2006). Esta estrategia permite a S. cerevisiae utilizar rápidamente la glucosa durante la fermentación produciendo etanol (make), mantener el metabolismo fermentativo para producir etanol independientemente de la presencia de oxígeno en el medio (acumulate) y una posterior utilización del etanol como fuente de carbono (consume). Si bien en condiciones de vinificación esta última etapa no ocurre habitualmente (salvo en los vinos de crianza biológica) debido a la pérdida de viabilidad y la ausencia de oxígeno, que es necesario para metabolizar el etanol.
Detoxificación del sulfito
El género Saccharomyces presenta diversos mecanismos para mitigar el efecto del sulfito, los cuales incluyen un incremento en los niveles de acetaldehído, que se combina con sulfito, la regulación de la ruta metabólica para la asimilación de sulfito y la detoxificación de sulfito expulsándolo del medio celular. Este último mecanismo es llevado a cabo por una transportador de membrana codificado por el gen SSU1 (García-Ríos y Guillamón 2019).
Cabe destacar que las cepas vínicas son más resistentes al dióxido de azufre que las cepas de otros entornos. Esta característica diferenciadora se puede atribuir a la presión selectiva ejercida por el ser humano durante el proceso de domesticación de la levadura para la producción de vino (García-Ríos y Guillamón 2022).
Hasta la fecha se han descrito tres reordenaciones cromosómicas diferentes que mejoran la detoxificación del sulfito en cepas enológicas de S. cerevisiae. Cada una de ellas da lugar a la sobreexpresión del gen SSU1 mediante la modificación de su promotor. La translocación recíproca de SSU1 entre los cromosomas VIII y XVI genera un alelo SSU-R con mayor nivel de expresión que el gen nativo debido al intercambio del promotor con el gen constitutivo ECM34 (Pérez-Ortı́n et al. 2002). La translocación entre los cromosomas XV y XVI (XVtXVI) posiciona el gen SSU1 bajo el control del promotor del gen ADH1, el cual está expresado de forma constitutiva (García-Ríos y Guillamón 2019; Zimmer et al. 2014). Por último, la tercera reordenación cromosómica que confiere resistencia al sulfito es una inversión cromosómica de 38,5 kb en el cromosoma XVI. Esta inversión confiere una tolerancia al sulfito similar a las reordenaciones mencionadas anteriormente (García‐Ríos et al. 2019).
Estas tres reordenaciones han ocurrido de manera independiente y tienen un resultado final similar, aunque con algunas características diferenciadoras. La translocación VIIItXVI es la más abundante en las poblaciones estudiadas, y la translocación XVtXVI es la más eficiente en términos de resistencia al sulfito. Recientemente se ha identificado una reordenación cromosómica en Saccharomyces uvarum independiente de las observadas en S. cerevisiae. Las reordenaciones previamente descritas y el ejemplo identificado en S. uvarum son ejemplo de cómo la presión selectiva ejercida por el ser humano genera eventos de evolución convergente (García-Ríos y Guillamón 2022).
Introgresiones en S. cerevisiae
Tras la secuenciación de 1011 genomas de S. cerevisiae (Peter et al. 2018) se identificaron 913 ORF (Open Reading Frame) procedentes de Saccharomyces paradoxus en el pangenoma de S. cerevisiae. De las 1011 cepas secuenciadas, todas tenían al menos una ORF procedente de S. paradoxus, siendo la media de ORF por genoma de 26. La presencia de estas introgresiones demuestra una trasferencia de genes mediante hibridación interespecífica entre estas dos especies y que esta transferencia no es un evento singular, si no que está presente en mayor o menor medida en todas las cepas estudiadas.
Las introgresiones de S. paradoxus en el pangenoma de S. cerevisiae no son exclusivas de esta especie. Se han identificado diversas contribuciones al pangenoma de S. cerevisiae por otras especies más alejadas filogenéticamente mediante transferencia horizontal. El primer ejemplo detectado en una cepa vínica es el de EC1118, donde se detectaron tres regiones denominadas A, B y C procedentes de las especies Zygosaccharomyces bailii, Torulaspora microellipsoides y Torulaspora delbrueckii (Novo et al. 2009; Marsit et al. 2015). Algunos de estos eventos de transferencia horizontal se han relacionado con la adquisición de adaptaciones a un entorno fermentativo (Devia et al. 2020; Galeote et al. 2010).
La adición al pangenoma de S. cerevisiae de una dehidrorootato deshidrogenasa de origen bacteriano supone a nivel filogenético una de las adaptaciones más relevantes a entornos fermentativos. Aunque los organismos eucariotas poseen esta enzima, necesaria para la síntesis de la pirimidina, su actividad es dependiente de enzimas de la cadena respiratoria. La adquisición del gen de origen bacteriano por algunos integrantes de la familia Saccharomycetaceae les ha permitido la síntesis de pirimidina en ausencia de oxígeno utilizando el fumarato como aceptor de electrones (Hall, Brachat, y Dietrich 2005; Gojković et al. 2004). Este evento de transferencia horizontal supuso una clara ventaja a la hora de imponerse en medios anaerobios como el que se produce durante la fermentación del mosto, y se ha relacionado con la estrategia MAC (Piskur et al. 2006).
Plásmido de 2 micrómetros
Uno de los elementos extracromosómicos más comunes en procariotas son los plásmidos. Sin embargo, estos fragmentos circulares de DNA también pueden aparecer en eucariotas. En concreto, en el núcleo de S. cerevisiae encontramos frecuentemente el plásmido de 2 micrómetros. Se encuentra presente en muchas levaduras vínicas portadoras en un número de copias variable entre 1 y 210 (Peter et al. 2018), y tiene un tamaño de 6,3 kb. Considerado un elemento de naturaleza “egoísta” codifica únicamente para cuatro proteínas (Rep1, Rep2, Raf1 y Flp) relacionadas con la segregación del plásmido entre las células hijas, mantenimiento del número de copias en la célula y estabilidad de la molécula (Chan et al. 2013). Debido precisamente a su gran estabilidad y alto número de copias, se emplea ya desde los años 80 como vector para la expresión de genes de interés (Rizvi, Prajapati, y Ghosh 2018; Broach 1983). Se han identificado tres tipos diferentes de este plásmido, el A, el C y el B, siendo este último una versión híbrida entre las otras dos. El tipo A es el que tiene mayor representación en cepas enológicas de S. cerevisiae (Strope et al. 2015).
Genoma mitocondrial
En cada célula haploide de S. cerevisiae existen aproximadamente de 50 a 200 copias de DNA mitocondrial (Solieri 2010), lo cual corresponde al 15% del DNA total en la célula (Williamson 2002). Está compuesto en su mayoría por fragmentos lineales de 75 a 150 kb, aunque también encontramos un pequeño número de moléculas circulares (Williamson 2002; Westermann 2014). Una característica reseñable es que en S. cerevisiae el DNA mitocondrial posee un bajo contenido general de GC, así como regiones intergénicas extensas compuestas principalmente por adenosina y timina que conforma el 62% del genoma mitocondrial (Foury et al. 1998; de Zamaroczy y Bernardi 1986).
A pesar de su importancia para diversos procesos celulares (McBride, Neuspiel, y Wasiak 2006), mutaciones que afectan a la fosforilación oxidativa (fenotipo petite) e incluso la pérdida total del genoma mitocondrial (fenotipo rho0), no resultan letales para S. cerevisiae siempre que existan fuentes de carbono fermentables (Chen y Clark-Walker 2000).
Sin embargo, algunos estudios afirman que estas deficiencias en el DNA mitocondrial comprometen la supervivencia de Saccharomyces a altas y bajas temperaturas (Zubko y Zubko 2014; X. C. Li et al. 2019) o afectan a la tolerancia al etanol (Jiménez y Benítez 1988). De hecho, se ha observado que la transferencia del genoma mitocondrial de levaduras provenientes de velo de flor de vinos de Jerez a levaduras rho– es capaz de conferir resistencia a etanol (Ibeas y Jimenez 1997). Adicionalmente, la herencia mitocondrial parece tener un gran impacto en la resistencia a estrés oxidativo y al proceso de deshidratación realizado en la industria durante la producción de cultivos iniciadores (Picazo et al. 2015).
Debido a estas implicaciones, es clara la importancia del genoma mitocondrial para la industria vitivinícola. De hecho, hace unos años se desarrolló un innovador método basado en los patrones de restricción del DNA mitocondrial que permite diferenciar entre cepas de S. cerevisiae, distinguiendo así la cepa inoculada de las cepas salvajes presentes en el mosto. Esta técnica se ha propuesto como un control de que el proceso de fermentación está realmente dirigido por la cepa inoculada (Querol, Barrio, y Ramón 1992). Siguiendo esta línea, se ha descrito un método de PCR basado en las variaciones en el número y posición de intrones en el gen mitocondrial COX1 ente distintas cepas de S. cerevisiae con la ventaja de que no requiere la purificación de DNA genómico (López et al. 2003).
Ciclo de vida de S. cerevisiae
S. cerevisiae puede experimentar tanto reproducción sexual como asexual, permitiendo su adaptación a distintas condiciones ambientales. Si éstas son óptimas, se multiplicará por gemación mediante una mitosis asimétrica dando lugar a una protuberancia que finalmente se convertirá en la célula hija (Fig. 2). Este proceso pueden sufrirlo tanto células haploides como diploides. Prácticamente todas las células enológicas son diploides (Bradbury et al. 2006) debido posiblemente a su estabilidad genética, tolerancia al estrés y capacidad de adaptación (Vamvakas y Kapolos 2020; Mangado et al. 2018; B.-Z. Li et al. 2010).
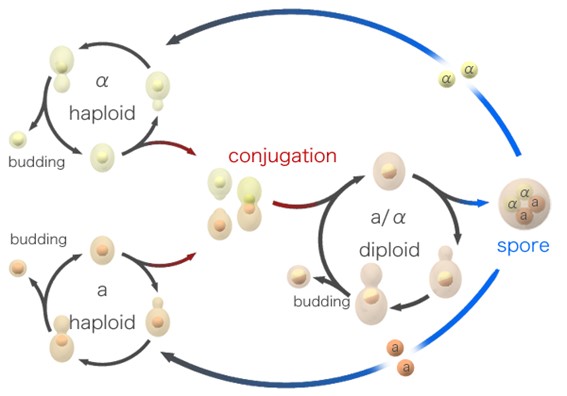
Sin embargo, si las condiciones no son favorables, las células diploides pueden llevar a cabo la meiosis, para generar un asca con cuatro ascosporas haploides sexualmente diferentes, dos de tipo MATa y dos MATα. Éstas pueden combinarse a su vez para formar una célula diploide MATa/α (Fig. 2). El tipo sexual viene determinado por el locus MAT que se encuentra en el cromosoma III de S. cerevisiae. Cada uno de los alelos MAT expresa proteínas diferentes que, a través de una serie de señales de activación o represión transcripcional, van a regular el comportamiento sexual de las células (Haber 2012).
Además, en S. cerevisiae diferenciamos entre cepas homotálicas y heterotálicas. Las cepas homotálicas son las más comunes en la naturaleza y pueden llevar a cabo un cambio sexual. A partir del segundo ciclo de división, una célula haploide que haya llevado a cabo la mitosis puede cambiar su condición sexual favoreciendo así la formación de diploides homocigotos. Durante este proceso de cambio, el alelo para MAT es reemplazado por el alelo opuesto gracias a la acción de la endonucleasa HO. En cada extremo del cromosoma III se encuentra el locus HMRa y el HMLα, que contienen la información para generar cada cassette MAT, pero permanecen silenciados. De esta forma, la endonucleasa HO genera una ruptura de doble hebra en el locus MAT que desencadena el reemplazo por el alelo contrario empleando la información genética de HMRa o HMLα (Lee y Haber 2015; Duina, Miller, y Keeney 2014). Este proceso está en consonancia con la propuesta de “renovación del genoma” en la que las cepas vínicas pueden sufrir cambios que las transformen de una población heterocigota a una homocigota eliminando alelos deletéreos o letales (Mortimer et al. 1994).
En cuanto a las cepas heterotálicas, pueden mantenerse como haploides de forma estable debido a la pérdida de la funcionalidad del gen HO, lo que las convierte en una herramienta muy útil para la investigación.
Siguiendo esta línea, se ha observado que la generación de híbridos entre cepas de S. cerevisiae puede dar lugar a fenotipos con mayor capacidad de fermentación y producción de metabolitos secundarios (Bonciani et al. 2016). Asimismo, algunos estudios muestran que la hibridación entre especies de Saccharomyces puede generar nuevas cepas, algunas de las cuales se han seleccionado por su impacto en el resultado final del vino. Se han descrito híbridos que aportan una serie de características relevantes para la industria como la reducción en la concentración de L-malato y sulfitos (Kanter et al. 2020) o diferencias en el perfil aromático, concentración de glicerol y etanol respecto a sus progenitores (Pérez-Torrado et al. 2017; Gamero et al. 2011; González et al. 2007; Bellon et al. 2011).
Fenotipo killer
El fenotipo killer en S. cerevisiae consiste en la producción de una serie de toxinas de naturaleza proteica, que pueden matar o inhibir el crecimiento de otras cepas de levadura y hongos filamentosos susceptibles, sin perjudicar a la levadura que las produce. Aunque se ha detectado su producción por otras especies de levaduras y géneros de hongos (Rodriguez-Cousiño, Gómez, y Esteban 2022; Bruenn 2001), fueron descubiertas inicialmente en S. cerevisiae (Bevan y Makower 1963), en la cual se conocen específicamente las toxinas K1, K2, K28, Klus, KHR1 y KHS1 (Billerbeck, Walker, y Pretorius 2024). A excepción de KHR1 y KHS1, que se han identificado en el genoma nuclear, el resto están codificadas por RNA de doble cadena asociados a micovirus de las familias Totiviridae y Partitiviridae (Crabtree et al. 2023). La transmisión de estos virus es tanto vertical (de madre a hija durante la división celular), como horizontal (mediante la fusión de células), como en la hibridación sexual (Schmitt y Breinig 2002). Sin embargo, no se ha identificado una vía de transmisión extracelular. En el citoplasma de la célula se encuentran las partículas virales cuya cápside encierra dos tipos de genoma. El más extenso, llamado genoma “L”, codifica para las proteínas de la cápside y la maquinaria replicativa. El genoma “M” codifica para la toxina. Estas toxinas actúan en la célula a través de distintos mecanismos. La mayoría se une a proteínas de la pared celular del microorganismo objetivo, provocando la formación de poros en la membrana plasmática. Sin embargo, la toxina K28 es internalizada por endocitosis y posteriormente llega al núcleo donde bloquea el ciclo celular (Schmitt y Breinig 2006; Bussey 1991). En el contexto del vino, las toxinas producidas por distintas levaduras ofrecen una oportunidad para el control de crecimiento microbiano (Branco et al. 2021; Comitini et al. 2021; Pinto et al. 2020). De hecho, se han propuesto cepas de S. cerevisiae como agentes de control de otros organismos durante la fermentación, con impacto sobre el perfil aromático del vino (Fernández de Ullivarri et al. 2024). Hay que destacar que en fermentaciones espontáneas del suroeste de España se han encontrado levaduras que producen principalmente K2 y de forma minoritaria Klus (Maqueda et al. 2012). Adicionalmente, se ha observado que ambas toxinas son muy activas a valores de pH relevantes para la elaboración del vino (de Ullivarri, Mendoza, y Raya 2014).
Además de los virus de las toxinas killer, existen otros elementos que se heredan de forma no mendeliana en S. cerevisiae, como los elementos de tipo prion. Se trata de proteínas que pueden cambiar a una conformación alternativa que se propaga por interacción con las proteínas en la conformación principal, afectando a su función (Wickner et al. 2007). Se ha propuesto que algunos elementos de tipo prion podrían ser relevantes en la ecología de las levaduras enológicas, pero estos resultados son controvertidos (Jarosz et al. 2014; Gonzalez et al. 2018).
Otros elementos que constituyen una fuente importante de variabilidad genética son los retrotransposones, que se transcriben a RNA y a continuación se retrotranscriben a DNA para insertarse en nuevas ubicaciones del genoma. En S. cerevisae encontramos retrotransposones de repetición terminal larga (LTR) que se clasifican en un rango de familias que abarcan desde Ty1 hasta Ty5 (Bleykasten-Grosshans et al. 2021). Después de la transposición, pueden quedar a modo de “cicatrices” LTR residuales (elementos delta) que marcan la zona del genoma donde ha habido un transposón. Aprovechando estas secuencias, se han desarrollado técnicas de amplificación por PCR de regiones “interdelta” para diferenciar entre cepas de S. cerevisiae (Legras y Karst 2003; Ness et al. 1993; Cottrell 2023).
Conclusión
A través de su evolución, las cepas enológicas de S. cerevisiae han adquirido una serie de características genéticas y genómicas que les han permitido predominar en este ambiente, haciéndolas más tolerantes a factores de estrés tanto generales como específicos de la fermentación. El conocimiento de estas adaptaciones es muy relevante para el desarrollo, como cultivos iniciadores, de nuevas cepas enológicas de S. cerevisiae con características alineadas con las demandas actuales del mercado. Esto se puede conseguir mediante la selección de nuevos aislados naturales o mediante técnicas de mejora genética, como la mutagénesis al azar y la hibridación inter- o intraespecífica (como se describe en otros capítulos de este dosier). En cualquier caso, hay que tener en cuenta las interacciones ecológicas de los cultivos iniciadores de S. cerevisiae con otras cepas de levaduras, tanto Saccharomyces como no-Saccharomyces, así como el uso eventual de cultivos iniciadores de otras especies.
Agradecimientos
Este trabajo ha sido financiado por el Gobierno de España a través del proyecto PID2022-136815OB-I00 y la ayuda PRE2020-093420 (contrato de MMO) financiados por MCIN/AEI /10.13039/501100011033.
Referencias
Belda, Ignacio, Javier Ruiz, Antonio Santos, Nïel Van Wyk, y Isak S. Pretorius.: “Saccharomyces cerevisiae“. Trends in Genetics; 2019, 35 (12): 956-57. https://doi.org/10.1016/j.tig.2019.08.009
Bellon, Jennifer R, Jeffery M Eglinton, Tracey E Siebert, Alan P Pollnitz, Louisa Rose, Miguel de Barros Lopes, y Paul J Chambers: “Newly generated interspecific wine yeast hybrids introduce flavour and aroma diversity to wines”. Applied Microbiology and Biotechnology; 2011, 91 (3): 603-12. https://doi.org/10.1007/s00253-011-3294-3
Bevan, E.A., y M. Makower : “The physiological basis of the killer character in yeast”. Proc.Xlth.Int Congr.Genet. 1963, 1: 202-3. https://www.cabidigitallibrary.org/doi/full/10.5555/19641601453
Billerbeck, Sonja, Roy S.K. Walker, y Isak S Pretorius : 2Killer yeasts: expanding frontiers in the age of synthetic biology”. Trends in Biotechnology; 2024, 42 (9): 1081-96. https://doi.org/10.1016/j.tibtech.2024.03.003
Bleykasten-Grosshans, Claudine, Romeo Fabrizio, Anne Friedrich, y Joseph Schacherer: “Species-Wide Transposable Element Repertoires Retrace the Evolutionary History of the Saccharomyces cerevisiae Host”. Edit. Jeffrey P Townsend. Molecular Biology and Evolution; 2021, 38 (10): 4334-45. https://doi.org/10.1093/molbev/msab171
Bonciani, Tommaso, Lisa Solieri, Luciana De Vero, y Paolo Giudici: “Improved wine yeasts by direct mating and selection under stressful fermentative conditions”. European Food Research and Technology; 2016, 242 (6): 899-910. https://doi.org/10.1007/s00217-015-2596-6
Bradbury, John E, Keith D. Richards, Heather A. Niederer, Soon A. Lee, P. Rod Dunbar, y Richard C. Gardner: “A homozygous diploid subset of commercial wine yeast strains”. Antonie van Leeuwenhoek; 2006, 89 (1): 27-37. https://doi.org/10.1007/s10482-005-9006-1
Branco, Patrícia, Rute Coutinho, Manuel Malfeito-Ferreira, Catarina Prista, y Helena Albergaria: “Wine Spoilage Control: Impact of Saccharomycin on Brettanomyces bruxellensis and Its Conjugated Effect with Sulfur Dioxide”. Microorganisms; 2021, 9 (12): 2528. https://doi.org/10.3390/microorganisms9122528
Broach, James R.: “Construction of high copy yeast vectors using 2-microns circle sequences”. Methods in enzymology; 1983, 101 (C): 307-25. https://doi.org/10.1016/0076-6879(83)01024-1
Bruenn, Jeremy: “The Double-Stranded RNA Viruses of Ustilago Maydis and Their Killer Toxins”. En dsRNA Genetic Elements; 2001, 109-24. CRC Press. https://doi.org/10.1201/9781420039122.ch4
Bussey, H.: “K1 killer toxin, a pore‐forming protein from yeast”. Molecular Microbiology; 1991, 5 (10): 2339-43. https://doi.org/10.1111/j.1365-2958.1991.tb02079.x
Chan, Keng-Ming, Yen-Ting Liu, Chien-Hui Ma, Makkuni Jayaram, y Soumitra Sau: “The 2 micron plasmid of Saccharomyces cerevisiae: A miniaturized selfish genome with optimized functional competence”. Plasmid; 2013, 70 (1): 2-17. https://doi.org/10.1016/j.plasmid.2013.03.001
Chen, Xin Jie, y G. Desmond Clark-Walker: “The petite mutation in yeasts: 50 years on”. International review of cytology; 2000, 194: 197-238. https://doi.org/10.1016/s0074-7696(08)62397-9
Comitini, Francesca, Alice Agarbati, Laura Canonico, y Maurizio Ciani: “Yeast interactions and molecular mechanisms in wine fermentation: A comprehensive review”. International Journal of Molecular Sciences; 2021, 22 (14): 7754. https://doi.org/10.3390/ijms22147754
Conant, Gavin C., y Kenneth H. Wolfe: “Increased glycolytic flux as an outcome of whole-genome duplication in yeast”. Molecular Systems Biology; 2007, 3 (204): 4292. https://doi.org/10.1038/msb4100170
Cottrell, Matthew T.: “Fingerprinting Saccharomyces cerevisiae Strains Using Next Generation Sequencing of PCR Amplicons Generated from Delta Elements”. Journal of the American Society of Brewing Chemists; 2023, 81 (3): 374-82. https://doi.org/10.1080/03610470.2022.2110645
Crabtree, Angela M., Nathan T. Taggart, Mark D. Lee, Josie M Boyer, y Paul A. Rowley: “The prevalence of killer yeasts and double-stranded RNAs in the budding yeast Saccharomyces cerevisiae”. FEMS Yeast Research; 2023, 23 (enero): 1-10. https://doi.org/10.1093/femsyr/foad046
Devia, Joaquín, Camila Bastías, Eduardo I. Kessi-Pérez, Carlos A. Villarroel, Matteo De Chiara, Francisco A. Cubillos, Gianni Liti, Claudio Martínez, y Francisco Salinas: “Transcriptional Activity and Protein Levels of Horizontally Acquired Genes in Yeast Reveal Hallmarks of Adaptation to Fermentative Environments”. Frontiers in genetics; 2020, 11 (abril): 293. https://doi.org/10.3389/fgene.2020.00293
Duina, Andrea A., Mary E. Miller, y Jill B. Keeney: “Budding Yeast for Budding Geneticists: A Primer on the Saccharomyces cerevisiae Model System”. Genetics; 2014, 197 (1): 33-48. https://doi.org/10.1534/genetics.114.163188
Fernández de Ullivarri, Miguel, María Gabriela Merín, Raúl R. Raya, Vilma I. Morata de Ambrosini, y Lucía M. Mendoza: “Killer yeasts used as starter cultures to modulate the behavior of potential spoilage non-Saccharomyces yeasts during Malbec wine fermentation”. Food Bioscience; 2024, 57 (febrero): 103424. https://doi.org/10.1016/j.fbio.2023.103424
Foury, Françoise, Tiziana Roganti, Nicolas Lecrenier, y Bénédicte Purnelle: “The complete sequence of the mitochondrial genome of Saccharomyces cerevisiae”. FEBS Letters; 1998, 440 (3): 325-31. https://doi.org/10.1016/S0014-5793(98)01467-7
Galeote, Virginie, Maïté Novo, Madalena Salema-Oom, Christian Brion, Elisabete Valério, Paula Gonçalves, y Sylvie Dequin: “FSY1, a horizontally transferred gene in the Saccharomyces cerevisiae EC1118 wine yeast strain, encodes a high-affinity fructose/H+ symporter”. Microbiology; 2010, 156 (12): 3754-61. https://doi.org/10.1099/mic.0.041673-0
Gamero, Amparo, Purificación Hernández-Orte, Amparo Querol, y Vicente Ferreira: “Effect of aromatic precursor addition to wine fermentations carried out with different Saccharomyces species and their hybrids”. International Journal of Food Microbiology; 2011, 147 (1): 33-44. https://doi.org/10.1016/j.ijfoodmicro.2011.02.035
García-Ríos, Estéfani, y José Manuel Guillamón: “Mechanisms of Yeast Adaptation to Wine Fermentations”. En Progress in molecular and subcellular biology; 2019, 58:37-59. Springer Science and Business Media Deutschland GmbH. https://doi.org/10.1007/978-3-030-13035-0_2
———:” Genomic Adaptations of Saccharomyces Genus to Wine Niche”. Microorganisms; 2022, 10 (9): 1811. https://doi.org/10.3390/microorganisms10091811
García‐Ríos, Estéfani, Marcos Nuévalos, Eladio Barrio, Sergi Puig, y José M. Guillamón: “A new chromosomal rearrangement improves the adaptation of wine yeasts to sulfite”. Environmental Microbiology; 2019, 21 (5): 1771-81. https://doi.org/10.1111/1462-2920.14586
Gojković, Z., W. Knecht, E. Zameitat, J. Warneboldt, J.-B. Coutelis, Y. Pynyaha, C. Neuveglise, K. Møller, M. Löffler, y J. Piškur: “Horizontal gene transfer promoted evolution of the ability to propagate under anaerobic conditions in yeasts”. Molecular Genetics and Genomics; 2004, 271 (4): 387-93. https://doi.org/10.1007/s00438-004-0995-7
Gonzalez, Ramon, y Pilar Morales: “Truth in wine yeast”. Microbial Biotechnology; 2022, 15 (5): 1339-56. https://doi.org/10.1111/1751-7915.13848
Gonzalez, Ramon, Jordi Tronchoni, Ana Mencher, José Antonio Curiel, Alda Joao Rodrigues, Laura López-Berges, Cristina Juez, et al.: “Low Phenotypic Penetrance and Technological Impact of Yeast [GAR +] Prion-Like Elements on Winemaking”. Frontiers in microbiology; 2018, 9 (enero): 3311. https://doi.org/10.3389/fmicb.2018.03311
González, Sara S., Luisa Gallo, Ma. Dolores Climent, Eladio Barrio, y Amparo Querol: “Enological characterization of natural hybrids from Saccharomyces cerevisiae and S. kudriavzevii”. International Journal of Food Microbiology; 2007, 116 (1): 11-18. https://doi.org/10.1016/j.ijfoodmicro.2006.10.047
Haber, James E.: “Mating-Type Genes and MAT Switching in Saccharomyces cerevisiae”. Genetics; 2012, 191 (1): 33-64. https://doi.org/10.1534/genetics.111.134577
Hall, Charles, Sophie Brachat, y Fred S. Dietrich: “Contribution of Horizontal Gene Transfer to the Evolution of Saccharomyces cerevisiae”. Eukaryotic Cell; 2005, 4 (6): 1102-15. https://doi.org/10.1128/EC.4.6.1102-1115.2005
Ibeas, José Ignacio, y Juan Jiménez: “Mitochondrial DNA loss caused by ethanol in Saccharomyces flor yeasts”. Applied and Environmental Microbiology; 1997, 63 (1): 7-12. https://doi.org/10.1128/aem.63.1.7-12.1997
Jarosz, Daniel F., Jessica C.S. Brown, Gordon A. Walker, Manoshi S. Datta, W. Lloyd Ung, Alex K. Lancaster, Assaf Rotem, et al.: “Cross-Kingdom Chemical Communication Drives a Heritable, Mutually Beneficial Prion-Based Transformation of Metabolism”. Cell; 2014,158 (5): 1083-93. https://doi.org/10.1016/j.cell.2014.07.025
Jiménez, Juan, y Tahía Benítez: “Yeast cell viability under conditions of high temperature and ethanol concentrations depends on the mitochondrial genome”. Current Genetics; 1988, 13 (6): 461-69. https://doi.org/10.1007/BF02427751
Kanter, Jean-Philippe, Santiago Benito, Silvia Brezina, Beata Beisert, Stefanie Fritsch, Claus-Dieter Patz, y Doris Rauhut: “The impact of hybrid yeasts on the aroma profile of cool climate Riesling wines”. Food Chemistry; 2020, X 5 (marzo): 100072. https://doi.org/10.1016/j.fochx.2019.100072
Lee, Cheng-Sheng, y James E. Haber: “Mating-type Gene Switching in Saccharomyces cerevisiae”. Edit. Martin Gellert y Nancy Craig. Microbiology spectrum; 2015, 3 (2): MDNA3-0013-2014. https://doi.org/10.1128/microbiolspec.MDNA3-0013-2014
Legras, Jean-Luc, y Francis Karst: “Optimisation of interdelta analysis for Saccharomyces cerevisiae strain characterisation». FEMS Microbiology Letters; 2003, 221 (2): 249-55. https://doi.org/10.1016/S0378-1097(03)00205-2
Li, Bing-Zhi, Jing-Sheng Cheng, Ming-Zhu Ding, y Ying-Jin Yuan: “Transcriptome analysis of differential responses of diploid and haploid yeast to ethanol stress”. Journal of Biotechnology; 2010, 148 (4): 194-203. https://doi.org/10.1016/j.jbiotec.2010.06.013
Li, Xueying C, David Peris, Chris Todd Hittinger, Elaine A. Sia, y Justin C. Fay: “Mitochondria-encoded genes contribute to evolution of heat and cold tolerance in yeast”. Science Advances; 2019, 5 (1). https://doi.org/10.1126/sciadv.aav1848
López, Victoria, M. Teresa Fernández-Espinar, Eladio Barrio, Daniel Ramón, y Amparo Querol: “A new PCR-based method for monitoring inoculated wine fermentations”. International Journal of Food Microbiology; 2003, 81 (1): 63-71. https://doi.org/10.1016/S0168-1605(02)00194-0
Mangado, Ana, Pilar Morales, Ramon González, y Jordi Tronchoni: “Evolution of a Yeast With Industrial Background Under Winemaking Conditions Leads to Diploidization and Chromosomal Copy Number Variation”. Frontiers in microbiology; 2018, 9 (AUG): 1816. https://doi.org/10.3389/fmicb.2018.01816
Maqueda, Matilde, Emiliano Zamora, María L Álvarez, y Manuel Ramírez: “Characterization, Ecological Distribution, and Population Dynamics of Saccharomyces Sensu Stricto Killer Yeasts in the Spontaneous Grape Must Fermentations of Southwestern Spain”. Applied and Environmental Microbiology; 2012, 78 (3): 735-43. https://doi.org/10.1128/AEM.06518-11
Marsit, Souhir, Adriana Mena, Frédéric Bigey, François-Xavier Sauvage, Arnaud Couloux, Julie Guy, Jean-Luc Legras, Eladio Barrio, Sylvie Dequin, y Virginie Galeote: “Evolutionary Advantage Conferred by an Eukaryote-to-Eukaryote Gene Transfer Event in Wine Yeasts”. Molecular Biology and Evolution; 2015, 32 (7): 1695-1707. https://doi.org/10.1093/molbev/msv057
McBride, Heidi M., Margaret Neuspiel, y Sylwia Wasiak: “Mitochondria: More Than Just a Powerhouse”. Current Biology; 2006, 16 (14): R551-60. https://doi.org/10.1016/j.cub.2006.06.054
Mortimer, Robert K., Patrizia Romano, Giovanna Suzzi, y Mario Polsinelli: “Genome renewal: A new phenomenon revealed from a genetic study of 43 strains of Saccharomyces cerevisiae derived from natural fermentation of grape musts”. Yeast; 1994, 10 (12): 1543-52. https://doi.org/10.1002/yea.320101203
Ness, FréDéRique, Francois Lavallée, Denis Dubourdieu, Michel Aigle, y Laurent Dulau: “Identification of yeast strains using the polymerase chain reaction”. Journal of the Science of Food and Agriculture; 1993, 62 (1): 89-94. https://doi.org/10.1002/jsfa.2740620113
Novo, Maite, Frédéric Bigey, Emmanuelle Beyne, Virginie Galeote, Frédérick Gavory, Sandrine Mallet, Brigitte Cambon, et al.: “Eukaryote-to-eukaryote gene transfer events revealed by the genome sequence of the wine yeast Saccharomyces cerevisiae EC1118”. Proceedings of the National Academy of Sciences of the United States of America; 2009, 106 (38): 16333-38. https://doi.org/10.1073/pnas.0904673106
Pérez-Ortı́n, José E., Amparo Querol, Sergi Puig, y Eladio Barrio: “Molecular Characterization of a Chromosomal Rearrangement Involved in the Adaptive Evolution of Yeast Strains». Genome Research; 2002, 12 (10): 1533-39. https://doi.org/10.1101/gr.436602
Pérez-Torrado, Roberto, Kalliopi Rantsiou, Benedeta Perrone, Elisabeth Navarro-Tapia, Amparo Querol, y Luca Cocolin: “Ecological interactions among Saccharomyces cerevisiae strains: Insight into the dominance phenomenon”. Scientific Reports; 2017, 7 (1): 1-10. https://doi.org/10.1038/srep43603
Peter, Jackson, Matteo De Chiara, Anne Friedrich, Jia-Xing Yue, David Pflieger, Anders Bergström, Anastasie Sigwalt, et al.: “Genome evolution across 1,011 Saccharomyces cerevisiae isolates”. Nature; 2018, 556 (7701): 339-44. https://doi.org/10.1038/s41586-018-0030-5
Picazo, C., E. Gamero-Sandemetrio, H. Orozco, W. Albertin, P. Marullo, E. Matallana, y A. Aranda: “Mitochondria inheritance is a key factor for tolerance to dehydration in wine yeast production”. Letters in Applied Microbiology; 2015, 60 (3): 217-22. https://doi.org/10.1111/lam.12369
Pinto, L., F. Baruzzi, L. Cocolin, y M. Malfeito-Ferreira: “Emerging technologies to control Brettanomyces spp. in wine: Recent advances and future trends”. Trends in Food Science & Technology; 2020, 99 (mayo): 88-100. https://doi.org/10.1016/j.tifs.2020.02.013
Piskur, Jure, Elzbieta Rozpedowska, Silvia Polakova, Annamaria Merico, y Concetta Compagno: “How did Saccharomyces evolve to become a good brewer?”. Trends in genetics; 2006, TIG 22 (4): 183-86. https://doi.org/10.1016/j.tig.2006.02.002
Querol, Amparo, Eladio Barrio, y Daniel Ramón: “A Comparative Study of Different Methods of Yeast Strain Characterization”. Systematic and Applied Microbiology; 1992, 15 (3): 439-46. https://doi.org/10.1016/S0723-2020(11)80219-5
Rizvi, Syed Meraj Azhar, Hemant Kumar Prajapati, y Santanu Kumar Ghosh: “The 2 micron plasmid: a selfish genetic element with an optimized survival strategy within Saccharomyces cerevisiae”. Current Genetics; 2018, 64 (1): 25-42. https://doi.org/10.1007/s00294-017-0719-2
Rodríguez-Cousiño, Nieves, Pilar Gómez, y Rosa Esteban: “Expression of the K74 Killer Toxin from Saccharomyces paradoxus Is Modulated by the Toxin-Encoding M74 Double-Stranded RNA 5’ Untranslated Terminal Region”. Edit. Nicole R. Buan. Applied and environmental microbiology; 2022, 88 (8): e0203021. https://doi.org/10.1128/aem.02030-21
Schmitt, Manfred J., y Frank Breinig: “The viral killer system in yeast: from molecular biology to application”. FEMS Microbiology Reviews; 2002, 26 (3): 257-76. https://doi.org/10.1111/j.1574-6976.2002.tb00614.x
———: “Yeast viral killer toxins: lethality and self-protection”. Nature Reviews Microbiology; 2006, 4 (3): 212-21. https://doi.org/10.1038/nrmicro1347
Solieri, Lisa: “Mitochondrial inheritance in budding yeasts: towards an integrated understanding”. Trends in Microbiology; 2010, 18 (11): 521-30. https://doi.org/10.1016/j.tim.2010.08.001
Strope, Pooja K., Stanislav G. Kozmin, Daniel A. Skelly, Paul M. Magwene, Fred S. Dietrich, y John H. McCusker: “2μ plasmid in Saccharomyces species and in Saccharomyces cerevisiae”. Edit. Cletus Kurtzman. FEMS Yeast Research; 2015, 15 (8): fov090. https://doi.org/10.1093/femsyr/fov090
Ullivarri, Miguel Fernández de, Lucía M. Mendoza, y Raúl R. Raya: “Killer activity of Saccharomyces cerevisiae strains: partial characterization and strategies to improve the biocontrol efficacy in winemaking”. Antonie van Leeuwenhoek. Springer Nature; 2014, 106 (5): 865-78. https://doi.org/10.1007/s10482-014-0256-7
Vamvakas, Sotirios-Spyridon, y John Kapolos: “Factors affecting yeast ethanol tolerance and fermentation efficiency”. World Journal of Microbiology and Biotechnology; 2020, 36 (8): 114. https://doi.org/10.1007/s11274-020-02881-8
Westermann, Benedikt: “Mitochondrial inheritance in yeast”. Biochimica et Biophysica Acta (BBA) – Bioenergetics, 2014, 1837 (7): 1039-46. https://doi.org/10.1016/j.bbabio.2013.10.005
Wickner, Reed B., Herman K. Edskes, Frank Shewmaker, y Toru Nakayashiki: “Prions of fungi: inherited structures and biological roles”. Nature Reviews Microbiology; 2007, 5 (8): 611-18. https://doi.org/10.1038/nrmicro1708
Williamson, Don: “The curious history of yeast mitochondrial DNA”. Nature Reviews Genetics; 2002, 3 (6): 475-81. https://doi.org/10.1038/nrg814
Wolfe, Kenneth H., y Denis C. Shields: “Molecular evidence for an ancient duplication of the entire yeast genome”. Nature; 1997, 387 (6634): 708-13. https://doi.org/10.1038/42711
Zamaroczy, Miklos de, y Giorgio Bernardi: “The GC clusters of the mitochondrial genome of yeast and their evolutionary origin”. Gene; 1986, 41 (1): 1-22. https://doi.org/10.1016/0378-1119(86)90262-3
Zimmer, Adrien, Cécile Durand, Nicolás Loira, Pascal Durrens, David James Sherman, y Philippe Marullo: “QTL Dissection of Lag Phase in Wine Fermentation Reveals a New Translocation Responsible for Saccharomyces cerevisiae Adaptation to Sulfite”. Edit. Joseph Schacherer. PLoS ONE; 2014, 9 (1): e86298. https://doi.org/10.1371/journal.pone.0086298
Zubko, Elena I., y Mikhajlo K. Zubko: “Deficiencies in mitochondrial DNA compromise the survival of yeast cells at critically high temperatures”. Microbiological Research; 2014, 169 (2-3): 185-95. https://doi.org/10.1016/j.micres.2013.06.011






