Este artículo es la primera parte del proyecto ganador del II Premio Cristòfor Mestre i Artigas, fallado en 2011 por el Consejo Regulador del Cava, el Incavi y el Museo de las Culturas del Vino de Cataluña. El estudio identifica las características para determinar los aromas del vino y sus conclusiones permiten reducir el tiempo de crianza, mejorar la eficiencia en la elaboración y hacer desaparecer gustos no deseables en el proceso de envejecimiento.
Preámbulo general del proyecto
Las lías vínicas de fermentación son el residuo formado al decantar la biomasa de levaduras responsables de la fermentación alcohólica de un mosto. Esta población microbiológica será, en mayor o menor medida heterogénea, en función de la inoculación o no de una cepa de levadura seleccionada, y de su implantación. Poblaciones de bacterias lácticas y/o acéticas así como diferentes sales tartáricas y restos vegetales derivados del procesado de la vendimia, pueden encontrarse también acumulados en el fondo de un depósito tras la fermentación.
En la práctica existen múltiples formas que permiten su realización, y que quizás deriven del alto grado de empirismo que subyace a la técnica. Principalmente los protocolos se distinguen en función de la proporción de biomasa celular utilizada, el continente empleado (barricas o depósitos), y/o la frecuencia de resuspensiones de las lías durante el período de crianza. Todos estos parámetros no están sujetos a reglas precisas por lo que en la práctica industrial, la ejecución de la técnica puede variar considerablemente entre diferentes bodegas. Existe una correlación entre la evolución fisicoquímica y sensorial de un vino en contacto con sus lías de levadura, y el grado de autolisis de las mismas. Etimológicamente, el término autolisis es muy gráfico para describir la autodestrucción hidrolítica de la célula. Una importante dotación enzimática intracelular es liberada en respuesta a determinadas señales bioquímicas que preceden a la muerte celular. El inicio temporal de este proceso coincide con el ocaso de la fase tumultuosa, cuando el contenido nutritivo es ya escaso, y las células pierden progresivamente su capacidad para multiplicarse.
Durante el proceso se liberan de forma gradual al medio una importante cantidad de moléculas y biopolímeros, citosólicos y/o parietales, que modifican las características organolépticas de los vinos (equilibrio coloidal, estructura, estabilidad de color, perfil aromático, etc.). Las moléculas liberadas a partir de la ruptura autolítica se pueden clasificar según el siguiente esquema (figura 1):
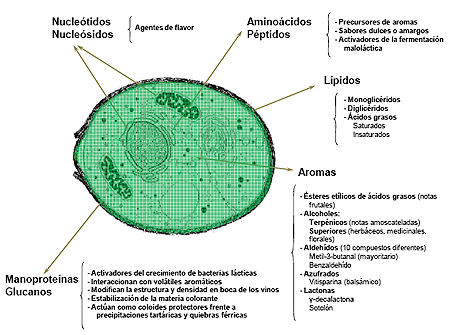
En el enriquecimiento y mejora de las cualidades gustativas de los vinos reside el gran atractivo e interés de la técnica, más aún considerando la actual estandarización del mercado, y la importante necesidad de las bodegas por diferenciarse en sus productos para ser competitivas. Debido a la gran cantidad de recursos que son necesarios para su realización resulta una técnica cara y no exenta de dificultades. Pero además de los inconvenientes de índole material intrínsecos, el enólogo debe ser consciente de que la adición al vino de lías supone un enriquecimiento en nutrientes, que pueden provocar crecimientos microbianos no deseados y desviaciones sensoriales derivadas. Por tanto, se requiere un especial cuidado en el seguimiento periódico de parámetros analíticos y sensoriales, ya que la técnica implica asumir cierta inestabilidad microbiológica.
En este ámbito, y con el propósito de reducir estos inconvenientes, la industria enológica ha desarrollado preparados enzimáticos comerciales con el fin de optimizar y acelerar la autolisis en vinos en crianza sobre lías. Estos productos son, generalmente, mezclas de varias actividades enzimáticas y permiten incrementar de forma muy notable y rápida las concentraciones de polisacáridos. Actualmente existe una gran diversificación en lo referente a estos productos, sin embargo pueden presentar una serie de inconvenientes. Entre los mismos, varios autores han descrito su falta de especificidad en condiciones de vinificación y/o la posible presencia de actividades contaminantes colaterales.
No en vano, la efectividad enzimática de este tipo de preparaciones, así como la naturaleza de su actividad dependen en gran parte de parámetros como la cepa fúngica utilizada o las condiciones de crecimiento empleadas en su producción. Resultarán cruciales a este respecto los protocolos de cada empresa para aislar y purificar cada actividad enzimática.
Además, la adición de enzimas aunque realizada de forma racional y juiciosa, no está exenta de cierta controversia debido en parte a la tendencia cada vez más extendida por parte del consumidor, de reclamar productos con la mínima cantidad de aditivos así como ser considerada por algunos puristas, como una práctica artificial y poco natural del enólogo.
La optimización de la biotecnología fermentativa mediante selección clonal clásica de levaduras, se realiza en base a criterios generales o clásicos, y específicos cada vez más ajustados al vino que se pretende elaborar. De hecho, estos criterios de interés enológico están en constante evolución y se actualizan a medida que se profundiza en el conocimiento de la fisiología/morfología de las levaduras. En muchas ocasiones los nuevos criterios de interés enológico para la selección de cepas, surgen de problemáticas enológicas concretas, como en el ámbito que nos ocupa las anteriormente comentadas.
Sin embargo, el protocolo industrial tradicional de la crianza sobre lías no permite la disociación desde el punto de vista microbiológico, entre la fase de fermentación alcohólica y la posterior etapa de crianza. Las exigencias de la etapa fermentativa requieren la participación «activa» de cepas con perfiles metabólicos óptimos según criterios específicos de vinificación. Pero estos criterios u objetivos difieren sensiblemente de los que serían propios y deseados en etapas posfermentativas cuando se apuesta por la participación «pasiva» de una determinada población de levaduras en contacto con el vino.
En este último caso, la generación exógena de una biomasa exenta de nutrientes y contaminantes a partir de una cultivo puro de levadura ya seleccionado –y su posterior adición al vino–, permitiría la aplicación de un proceso de selección según criterios puramente relacionados con la liberación autolítica de compuestos celulares. Se podría así optimizar la crianza sobre lías en cuanto a tiempos de crianza y características sensoriales asociadas, minimizando al tiempo los posibles riesgos microbiológicos.
Se pretenden valorar diferentes géneros de levadura Saccharomyces y no Saccharomyces, que a pesar de no ser fermentativamente adecuados, podrían mostrar comportamientos óptimos en crianza sobre lías debido a sus especiales carácterísticas ecofisiológicas. Existe una posibilidad real de aplicación de algunos géneros no Saccharomyces, explotando el importante capital natural de la biodiversidad y variabilidad genética que éstos representan.
I. PRIMER TRABAJO EXPERIMENTAL
Crianza sobre lías en vinos tintos. Efecto sobre la liberación de polisacáridos y el contenido de antocianos monómeros.
I.1. Introducción
Históricamente la crianza sobre lías se ha empleado en la elaboración de vinos blancos fermentados en barrica (Borgoña), vinos espumosos naturales (Champagne, Cava), y vinos de crianza biológica con levaduras de flor (Jerez). En la actualidad la crianza sobre lías de vinos tintos está siendo utilizada por muchas bodegas ya que permite la obtención de vinos de calidad permitiendo mejorar su estructura, perfil aromático y estabilidad de color.
La crianza sobre lías comienza con la autolisis de las levaduras que supone la hidrólisis de las envueltas celulares y la posterior cesión de sus moléculas y biopolímeros al medio (Babayan at al., 1981; Babayan & Bezrukov, 1985). La pared celular de S. cerevisiae está constituidas por manoproteínas entramadas por fibras de glucano y quitina (Pretorius, 2000). Durante la autolisis existe una desestructuración de la pared celular por rotura de las fibras de glucanos y quitina debido a la propia dotación enzimática de la levadura. También existe hidrólisis de proteínas que incrementa los contenidos nitrogenados del vino (Lurton at al., 1989; Sato at al., 1997); como consecuencia de esta despolimerización y proteólisis las envueltas celulares pierden rigidez (Feuillat, 1998). Las glucanasas, presentes en la pared hasta después incluso de 4 meses, y las manosidasas en menor parte, son las responsables de la degradación de las envueltas celulares (Charpentier y Fressinet, 1989). El aumento de la fracción lipídica, origina un enriquecimiento de la fracción aromática del vino, debido a reacciones secundarias de formación de ésteres y aldehídos (Pueyo at al., 2000).
Los polisacáridos liberados son agentes estabilizadores contra precipitaciones tartáricas (Lubbers at al., 1994), y proteicas (Moine-Ledoux at al., 1997). También interaccionan con la fracción fenólica, permitiendo una mayor estabilidad del contenido de antocianos monómeros (Saucier at al., 1997; Morata at al., 2005). La afinidad y el ratio de consumo potencial por el oxígeno de las lías alcanza valores mucho más altos que por la fracción polifenólica del vino (Fornairon-Bonnenfond & Salmon, 2003). Las lías pueden competir notablemente con los polifenoles por el oxígeno (Salmon, 2005), lo que explica en parte la mayor estabilidad de la materia colorante y la menor degradación de antocianos en los vinos así envejecidos.
Los preparados comerciales de enzimas β-glucanasas autorizados para el uso en enología incrementan de forma muy considerable las concentraciones de polisacáridos, y se sintetizan y aíslan a principalmente a partir de especies de Trichoderma, cultivados bajo condiciones que optimicen su producción y aislamiento (Humbert-Goffard at al., 2004).
El objetivo de este trabajo ha sido estudiar la liberación de polisacáridos de pared durante la lísis celular de cepas de levadura previamente seleccionadas seleccionadas de Saccharomyces, el efecto de la adición de enzimas β-glucanasas en la aceleración del proceso, y el efecto de la crianza sobre lías en la estabilidad del contenido de antocianos monómeros en un vino tinto elaborado con Vitis vinifera L. cv Tempranillo.
I.2. Materiales y métodos
I.2.1. Levaduras empleadas en el proceso experimental
Se emplearon las siguientes cepas de levaduras seleccionadas: 9CV, 5CV, 4CV, 7VA, 3VA, 2EV pertenecientes a la especie Sacch. cerevisiae, las cuales han sido aisladas y seleccionadas en el Laboratorio de Enología del Departamento deTecnología de Alimentos, UPM (Madrid, Spain), y también la cepa comercial S6U perteneciente a la especie S. uvarum (Lallemand, Danstar Ferment, Montreal, Canadá).
La biomasa de levadura para los ensayos de crianza sobre lías se obtuvo por fermentación de un medio YEPD (Kurtzman & Fell, 1998) enriquecido en glucosa hasta 100 g/L. Esta biomasa se lavó con volúmenes 10:1 de agua destilada estéril y se centrifugó (3000 rpm, 2 min) separando la biomasa del sobrenadante. La operación se repitió dos veces a fin de obtener una biomasa de levaduras sin restos de nutrientes. Posteriormente la biomasa de cada levadura multiplicada se liofilizó y se conservó refrigerada a 4 ºC.
I.2.2. Autolisis en medios sintéticos
Para cuantificar la cesión de polisacáridos se simularon crianzas sobre lías en un medio modelo compuesto por solución hidroalcohólica (agua:etanol, 90/10, v/v) acidulado a pH 3,5 con ácido tartárico. Este medio se dosificó en matraces Erlenmeyer de 100 mL a razón de 50 mL.
La cesión de polisacáridos fue estudiada utilizando las siete cepas de levadura previamente seleccionadas para la crianza sobre lías en vinos tintos, junto con un testigo sin levadura, y tres ensayos más a los que se añadió enzima β-glucanasa.
Sobre este medio modelo se adicionaron 0,8 g/L de levadura liofilizada. Los matraces se conservaron isotérmicamente a 30 ºC, y fueron sometidos semanalmente a agitación orbital, durante una hora, tratando de reproducir las condiciones de crianza reales en este tipo de crianzas.
I.2.3. Obtención de los polisacáridos a partir de los medios sintéticos
Los polisacáridos se recuperaron a partir de 1 mL de autolisado mediante precipitación en medio apolar ácido (etanol:HCl, 5 mL de Etanol 96 % v/v y 50 μl HCl 1 N). La precipitación se facilitó refrigerando a 4ºC durante 24 h; posteriormente se lavaron con 1 mL de etanol y se centrifugaron a 9000 rpm descartando el sobrenadante. Esta operación se repitió tres veces. El precipitado se deshidrató en estufa a 40 ºC. Finalmente se resuspendió en 1 mL de NaNO3 0,1 M, se filtró a 0,45 μm y se conservó refrigerado antes de su análisis HPLC-RI.
I.2.4. β-glucanasas
Las enzimas β-glucanasas adicionadas fueron LALLZYME MMX (Lallemand, Danstar Ferment, Montreal, Canadá) en dosis de 50 mg/L según lo recomendado por el fabricante.
I.2.5. Análisis de los polisacáridos mediante cromatografía líquida de alta presión con detección por índice de refracción (HPLC/RI)
Los polisacáridos se analizaron por cromatografía HPLC (Doco at al., 1996) mediante separación en columna de exclusión molecular ultrahidrogel 250 (Waters, MA), utilizando como eluyente NaNO3 0,1 M en agua MilliQ en régimen isocrático y detectando mediante índice de refracción (RI). El equipo utilizado fue un cromatógrafo Waters (Waters, MA) con bomba 600E, inyector 717p y detector IR 2412.
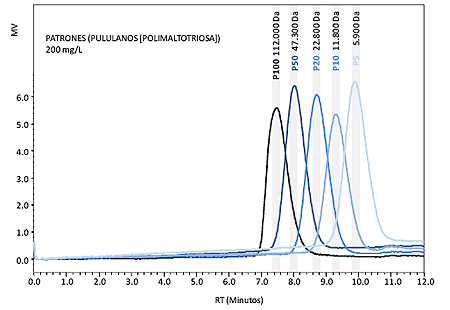
Para determinar el tamaño de los polisacáridos liberados durante la autolisis se utilizaron como marcadores patrones de pullulans (polymaltotriose) Shodex (Japan) de tamaño conocido: P-100 (112 KDa), P-50 (47,3 KDa), P-20 (22,8 KDa), P-10 (11,8 KDa), P-5 (5,9 KDa) (figura I.1). El contenido en polisacáridos de los cuantificó realizando una curva de calibrado con estándar externo utilizando los patrones de pullulanos anteriormente descritos.
I.2.6. Vinos
Se utilizaron vinos de Vitis vinifera L. cv. Tempranillo de la DO Ribera del Duero. El pH del mosto fue de 3,7 y el contenido azucarado 210 g/L. A los vinos se les añadieron dosis de 0,3 g/L de levadura liofilizada y se estudió la evolución del contenido de antocianos monómeros durante 420 días.
I.2.7. Análisis de antocianos mediante cromatografía líquida de alta presión (HPLC-PDAD)
Los antocianos contenidos en los vinos fueron analizados utilizando un cromatógrado HPLC Waters (Mildford, MA, USA) equipado con una controladora 600-MS, un inyector automático 717 Plus y un detector de fotodiodos 996.
Se utilizó un gradiente de disolventes A (agua/ácido fórmico, 90:10, v/v) y B (metanol) en una columna de fase reversa Nova-Pak C18 (300 x 3,9 mm). Se inyectaron volúmenes de muestra de 100 µL previamente filtrados mediante filtros de acetato de celulosa de 0,45 µm de diámetro de poro.
I.2.8. Medida de la intensidad de color y porcentaje de color
Se ha medido la absorbancia de los vinos a 420, 520 y 620 nm en un espectrofotómetro JASCO V-530 (Jasco, Japón) en una cubeta de cuarzo de 1 mm de longitud de paso de luz, siguiendo la metodología propuesta por Glories (Glories, 1984 a; Glories, 1984 b). Se calcularon la intensidad, tonalidad, y porcentajes de rojo, amarillo y azul.
I.2.9. Análisis estadísticos
Las medias, desviaciones estándar, ANOVAs y diferencias mínimas significativas se han calculado utilizando el software para PC Statgraphics 5.0 (Graphics Software Systems, Rockville, MD, USA).
I.3. Resultados, tratamientos estadísticos y discusión
I.3.1. Liberación de polisacáridos durante la crianza en medio sintético utilizando levaduras seleccionadas
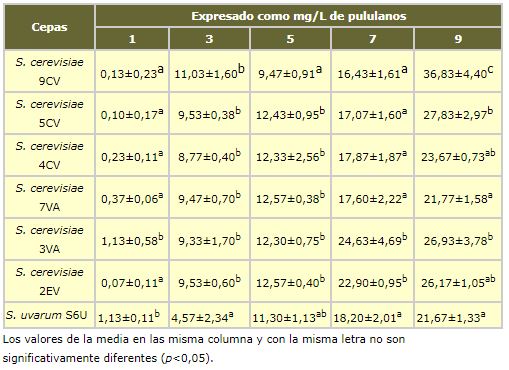
La tabla I.1 muestra el contenido de polisacáridos existente el mes 1º, 3º, 5º, 7º y 9º de un período de crianza sobre lías en medio modelo de 9 meses observándose que en todos los ensayos siguen una tendencia creciente y que es un proceso lento. Aunque se ha estudiado la posible existencia de diferencias entre las cepas utilizadas y se ha comprobado que son significativas para cada mes entre algunas de ellas (p<0.05), los resultados no son consistentes para las mismas levadura a lo largo de todo el período de autolisis, por lo que no se puede extrapolar que entre las cepas estudiadas existan levaduras de autolisis más rápida.
La elución de polisacáridos sucede desde el minuto 7 al 10,5 y aunque no hay diferenciación a línea de base por no ser una técnica de alta resolución. Se observa un pico claro a aproximadamente 7,3 minutos y otros menos marcados a 8,4 y 9,5 minutos (líneas de trazo continuo en figura I.2). Comparando con los marcadores de peso molecular estas bandas corresponden aproximadamente a 120.000, 23.000 y 7.000 Daltons (Morata at al., 2005). Esto es consistente con la forma aleatoria de rotura de la pared que hace que exista una sucesión de fragmentos de diverso tamaño. También se observa que la mayor cantidad de polisacáridos presentes en el noveno mes de autolisis corresponde a fragmentos de tamaño elevado (120.000-100.000 Da).
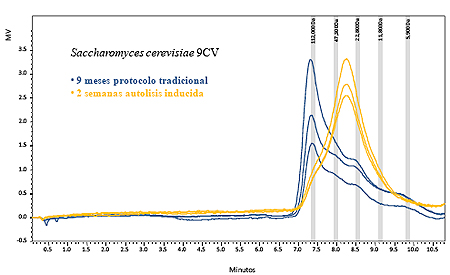
El estudio de la liberación de polisacáridos por HPLC-RI es complicado ya que esta técnica cromatográfica no tiene tan alta resolución como la cromatografía de fase reversa. La separación se realiza por tamaños eluyendo a tiempos más cortos los polímeros de mayor tamaño y a continuación los más pequeños. La separación no es en polímeros de igual tamaño sino que un pico agrupa polímeros de tamaño más o menos próximo.
El otro problema que dificulta el análisis proviene de lo que se está estudiando, que son fragmentos de pared celular rotos aleatoriamente cuando se autolisan las levaduras. Por tanto se va a obtener una sucesión de tamaños de distribución irregular. La pared celular de Saccharomyces cerevisiae es la cubierta celular exterior y se compone de polisacáridos y manoproteínas de tamaño variable entramadas por fibras de quitina y glucano (Pretorius, 2000).
Las condiciones anteriores hacen que la repetibilidad entre dos ensayos de autolisis en los que se ha puesto la misma biomasa de la misma cepa de levadura no sea tan alta como en otros métodos cromatográficos y las desviaciones estándar entre replicados sean altas. Esto es lógico por el carácter aleatorio del proceso de rotura de las paredes celulares en el cual influirán la mayor o menor resistencia estructural de cada levadura en las condiciones de daño mecánico producidas por la agitación, a la temperatura y a la liberación de enzimas líticas de la dotación enzimática de cada cepa.
I.3.2. Efecto de la adición de enzimas β-glucanasas
La adición al medio modelo enzimas β-glucanases acelera de forma notable el proceso consiguiéndose cantidades de polisacáridos iguales o superiores en dos semanas a las obtenidas sin enzimas después de 9 meses de autolisis (tabla I.2). Cuando se utilizan enzimas la repetibilidad entre replicados es más elevada y se obtienen desviaciones estándar más bajas. Al utilizarse enzimas el proceso es menos aleatorio y la lísis se completa de forma más regular. La primera semana prácticamente no existe autolisis (1.3-3.9 mg/L) valor a tiempo inicial en el cual la enzima no ha debido actuar suficientemente. A partir de la segunda semana ya existe un proceso de lísis enzimática muy importante que da lugar a una notable liberación de polisacáridos para todas las cepas de levadura estudiadas.
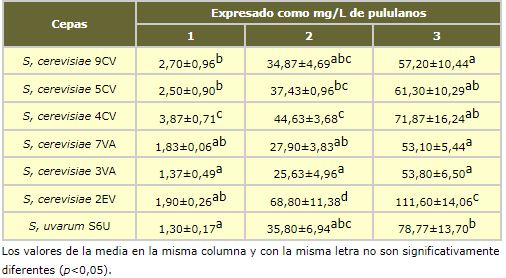
En general, el proceso utilizando enzimas comerciales es similar para las levaduras estudiadas excepto para la cepa 2EV que presenta una mayor cantidad de polisacáridos terminando con 111,6 mg/L mientras que el resto se encuentran en el rango 53,1-78,8 mg/L. Las diferencias entre la cepa 2EV y el resto son significativas para las semanas 2 y 3 (tabla I.2).
Otro hecho importante es que aunque la lísis enzimática de la pared celular es mucho más rápida, el efecto que se consigue no es igual, ya que los fragmentos de polisacáridos tienen un tamaño más regular y son más pequeños observándose en figura I.1 que existe una banda centrada en RT 8,2 min y que corresponde a un peso molecular de aproximadamente 35.000 Da. El contenido de polisacáridos de tamaño superior (120.000) e inferior (7000) es mucho menor que en la autolisis convencional, resultado lógico ya que ahora la β-glucanase hidroliza las fibras de glucano de forma menos aleatoria y más regular liberando fragmentos de tamaño más homogéneo.
La repercusión a nivel sensorial de este hecho debe estudiarse más profundamente ya que polisacáridos de menor tamaño pueden producir una sensación táctil en boca menos perceptible que la que producen los polisacáridos de tamaño superior liberados en la autolisis convencional. Por otra parte la estabilidad coloidal de los vinos enriquecidos con polisacáridos procedentes de lisis con β-glucanasa puede que sea mayor al ser estos de menor tamaño y por tanto menos proclives a precipitar.
I.3.3. Identificación de antocianos y piranoantocianos mediante HPLC-PDAD
Normalmente la crianza de vinos tintos supone una pérdida de antocianos monoméricos, porque éstos se degradan o evolucionan hacia formas no coloreadas o bien se polimerizan hacia formas más estables. No obstante en la crianza sobre lías no ocurre lo mismo, debido a que los polisacáridos y las manoproteínas liberados durante la autolisis ejercen un efecto protector sobre los antocianos monómeros de los vinos tintos jóvenes, lo que se traduce en una mayor persistencia de los colores rojo azulados.
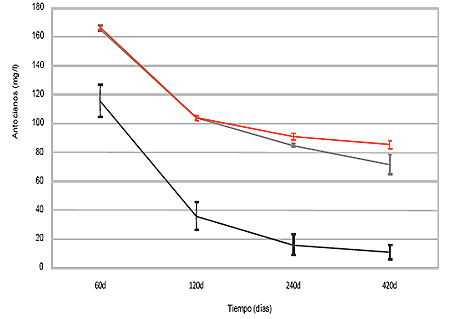
La concentración de antocianos totales más alta es la de la primera medición, realizada a los 60 días (figura I.2). En esta fecha los ensayos con enzima β-glucanasas poseen una concentración en mg/L de antocianos totales un 30 % inferior con respecto a las muestras de crianza sobre lías y testigos (véase pico de M3G en figura I.3).
El empleo de preparados comerciales de enzimas β-glucanasas supone una considerable reducción en la concentración de antocianos monómeros, probablemente porque las enzimas comerciales no son totalmente puras y presentan enzimas β-glicosidasas en pequeñas cantidades que puedan hidrolizar la glucosa que esterifica los antocianos, liberando moléculas más inestables (Wrolstad at al., 1994; Wightman & Wrolstad, 1996).
Las tendencias de las tres muestras han evolucionado en paralelo desde la primera medida, lo que significa que debido probablemente a la desnaturalización de las enzimas β-glucanasas, su acción sobre el color decrece una vez pasado un período inicial de actividad, en este caso los dos primeros meses. Estrechamente ligadas en su evolución las muestras de crianza sobre lías y testigos manifiestan a partir de los 120 días trayectorias diferentes. Las muestras envejecidas en crianza sobre lías alcanzan concentraciones en antocianos totales mayores que los testigos a los 420 días, existiendo diferencias significativas entre ambos valores (figura I.3), cuya posible justificación radica en el carácter reductor de las lías.
Según Rosenfeld (2003) y Foinairon & Salmon (2003) los índices en el consumo potencial de oxígeno de células viables de levaduras y lías son mucho más elevados que los de los polifenoles. Así, Vivas (2000) obtiene vinos menos oxidados cuando se han envejecido sobre lías, atribuyendo este efecto a la liberación de componentes celulares durante la autolisis de levaduras. También se ha observado que las lías impiden la oxidación de compuestos fenólicos durante el envejecimiento (Salmon, 2005). La liberación de polisacáridos durante la autolisis de levaduras y la competencia de las lías con los polifenoles por el oxígeno en las muestras en crianza sobre lías son los procesos responsables de la mayor estabilidad en el contenido de antocianos monómeros.
Por otro lado existe un período inicial hasta el cuarto mes en el cual ocurre una degradación mayoritaria con respecto a la total de antocianos. En este período los contenidos en antocianos totales merman sobre el total el 76,26 %, 66,24 % y el 76,34 % en los ensayos de crianza sobre lías, testigos y muestras enzimadas con β-glucanasas respectivamente.
I.3.4. Efecto de la crianza sobre lías en el contenido de pigmentos piranoantociánicos de elevada estabilidad
Las vitisinas son pigmentos de elevada estabilidad formados por condensación de antocianos y metabolitos liberados al medio durante la fermentación. Las vitisinas son más resistentes a la decoloración por anhídrido sulfuroso que otros antocianos (Bakker & Timberlake, 1997), y expresan colores más intensos que otros pigmentos a pH 4 (Atanasova at al., 2002). También, se ha demostrado la elevada correlación existente entre las cantidades cedidas al medio fermentativo de piruvato y acetaldehído, y la formación de vitisinas A y B respectivamente (Morata at al., 2003). La adición de piruvato y acetaldehído incentiva la formación de vitisinas A y B (Morata at al., 2007; Hayasaka at al., 2002; Romero at al., 2000).
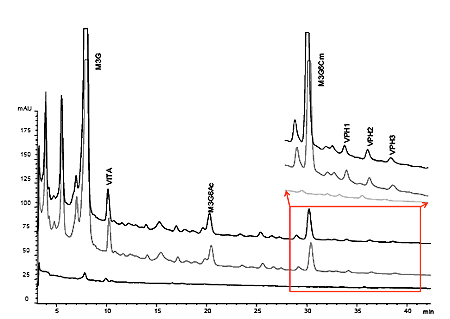
En la figura I.4, se muestran las tendencias en la evolución del malvidin-3-O-glucósido y de la vitisina A. En dicha gráfica se pone de manifiesto la elevada permanencia y menor degradación de pigmentos piranoantociánicos como la vitisina A, frente a antocianos glucósidos como el malvidin-3-O-glucósido. Mientras que la evolución en los contenidos en malvidin-3-O-glucósido sigue una tendencia análoga a la anteriormente vista de antocianos totales, la concentración de vitisina A se mantiene constante a lo largo del período de crianza sobre lías.
Llama especialmente la atención el comportamiento de ambos pigmentos en las muestras tratadas con β-glucanasas. En ellas la vitisina A tiene un comportamiento mucho más persistente que el malvidin-3-O-glucósido, lo que revela una menor degradación de color cuando se utilizan enzimas aceleradoras del proceso de autolisis. Esto puede justificar la selección de cepas de levadura productoras de altos contenidos de ácido pirúvico y acetaldehído para inducir la síntesis de estos pigmentos, especialmente en las condiciones de crianza sobre lías; contenidos importantes de anhídrido sulfuroso y pH elevado.
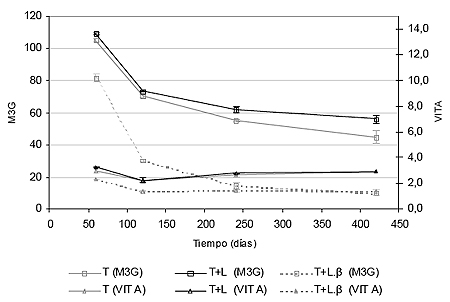
Existen otros pigmentos de elevada persistencia y cuya evolución en el vino está íntimamente ligada a los procesos de crianza sobre lías, como son los derivados vinilfenólico piranoantocianina (VPH). Los antocianos monómeros condensan de forma natural con vinilfenoles, originados en el vino por la descarboxilación de ácidos hidroxicinámicos, especialmente cuando se utilizan levaduras con actividad hidroxicinamato descarboxilasa (Morata at al., 2006). La gran estabilidad de estos pigmentos se debe a su cuarto anillo heteroaromático que permite la deslocalización de la carga positiva del antociano en dos moléculas de oxigeno. Asimismo estos pigmentos son más resistentes a decoloraciones por SO2 y a reducciones en la intensidad colorante a pH elevados ya que la condensación a partir de la cual se forman implica el bloqueo de la posición 4 del antociano.
La progresiva formación de vinilfenoles a lo largo de la crianza se solapa con el proceso de condensación anteriormente mencionado. La acción enzimática de las β-glucanasas supone grandes pérdidas en las concentraciones de antocianos totales, aunque la degradación sobre derivados más estables como vitisinas o aductos vinilfenólicos sea mucho menor (figura I.4).
En la formación de vinilfenoles, no se apreciaron grandes diferencias entre los diferentes ensayos. Los ácidos hidroxicinámicos se encuentran en el vino previamente al proceso de crianza, acumulándose en la baya antes del envero o bien formándose gracias a cepas de levadura hidroxicinamato decarboxilasa positivas. De esta forma la concentración de precursores en todas las muestras similar, lo que explica las escasas diferencias en las concentraciones de vinilfenoles.
4. Conclusiones
La crianza sobre lías de vinos tintos es una técnica que permite mejorar la estructura y densidad de los vinos incrementando sus caracteres sensoriales gustativos gracias a la liberación de polisacáridos. También permite una estabilización del contenido de antocianos monómeros lo que favorece una mayor estabilidad de color. La utilización de enzimas β-glucanasas reduce de forma importante el tiempo de crianza sobre lías pero se liberan polisacáridos de menor tamaño molecular y las preparaciones comerciales poseen actividades β-glicosidasa residuales que afectan negativamente al contenido de antocianos. La utilización de levaduras seleccionadas para vinificación en tinto y de rápida autolisis, en crianza sobre lías puede permitir un desarrollo más rápido y efectivo de esta técnica y reducir los inconvenientes de posibles contaminaciones y desviaciones organolépticas.
Bibliografía
Arizumi, K., Suzuki, Y., Kato i., Yagi, Y., Otsuka K. & Sato, M. (1994). Winemaking from Koshu variety by the sur lie method: change in the content of nitrogen compounds. American Journal of Enology and Viticulture. 3, 312-318.
Atanasova, V., Fulcrand, H., Chenyer, V. & Moutounet, M. (2002). Effect of oxygenation on polyphenol changes occurring in the course of wine making. Analytica Chimica Acta. 45, 15-27.
Babayan, T.L. & Bezrukov, M.G., (1985). Autolysis in yeast. Acta Biotechnology. 2, 129-136.
Babayan, T.L., Bezrukov, M.G., Latov, V., Belikov, V., Belavtseva, E. & Titova, E. (1981). Induced autolysis of Saccharomyces cerevisiae: morphological effects, rheological effects, and dynamics of accumulation of extracelular hydrolysis products. Current. Microbiology. 5, 163-168.
Bakker, J. & Timberlake, C. F. (1997). Isolation, Identification and characterization of new color-stable anthocyanins occurring in some red wines. Journal of Agriculture and Food Chemistry. 45, 35-43.
Charpentier, C. & Freyssinet, M. (1989). The mechanism of autolysis in wine. Yeast. 5, 181-186.
Charpentier, C., Nguyen Van Long, T., Bonaly R. & Feuillat, M. (1986). Alteration of cell wall structure in Saccharomyces bayanus during autolysis. Applied Microbiology and. Biotechnology. 24, 405-413.
Doco, T., Brillouet, J. M., Moutounet, M. (1996). Evolution of grape (Carignan noir cv.) and yeast polysaccharides during fermentation and post-maceration. American Journal of Enology and Viticulture. 47, 108-110.
Feuillat, M (1998). Autolyse del levures. Enologie. Fondements scientifiques et technologiques. Ed. Tec & Doc Lavoisier, Paris. 450-454.
Fornairon-Bonnefond, C. & Salmon, J.M. (2003). Impact of oxygen comsumption by yeast lees on the autolysis phenomenon during simulation of wine aging on lees. Journal of Agriculture and. Food Chemistry. 51, 2584-2590.
Hayasaka, Y. & Asenstorfer, R. E. (2002). Screening for potential pigments derived from anthocyanins in red wine using nanoelectrospray tandem mass spectrometry. Journal of Agriculture and. Food Chemistry. 50, 756-761.
Humbert-Goffard, A., Saucier, C., Moine-Ledoux, V., Canal-Llauberes, R. M., Dubordieu, D. & Glories, Y. (2004). An assay for glucanase activity in wine. Enzyme and Microbial Technology. 34, 537-543.
Kurtzman, C.P., Fell, J. W. (1998). Methods for the isolation, maintenance and identification of yeasts. The Yeast, a taxonomic study. Ed. Elsevier, Amsterdam, 79-80.
Lubbers, S., Charpentier, C., Feuillat, M. & Voilley, A. (1994). Influence of yeast walls on the behavior of aroma compounds in a model wine. American Journal of Enology and Viticulture. 1, 29-33.
Lurton, L., Segain, J.P. & Feuillat M. (1989). Etude de la protéolyse au cours de l’autolyse de levures en milieu acide. Sciences des Aliments. 9, 111-124.
Moine-Ledoux, V., Perrin A., Paladau, I. & Debourdieu, D. (1997). Premiers resultats de stabilisation tartrique des vins par addition de mannoprotéines purifiées (MannostabTM). Journal International des Sciences de la Vigne et du Vin. 31, 1,23-29.
Monagas, M., Núñez, V., Bartolomé, B. & Gómez-Cordovés, C. (2003) Anthocyanin-derived pigments in Graciano, Tempranillo and Cabernet-Sauvignon wines produced in Spain. American Journal of Enology and Viticulture. 54, 163-169.
Morata, A., Calderón, F., González, M.C., Colomo, B. & Suárez, J.A. (2005). Crianza sobre lías, chips y microoxigenación, utilización conjunta en el envejecimiento de vinos tintos. Ventajas del uso de levaduras seleccionadas. Enólogos. 34, 52-56.
Morata, A., Calderón, F., González, M.C., Gómez-Cordovés, M.C. & Suárez, J.A. Formation of higly stable pyranoanthocyanins (vitisins A and B) in red wines by the addition of pyruvic acid and acetaldehyde (2007). Food Chemistry. 100, 1144-1152.
Morata, A., Gómez-Cordovés, M. C., Calderón, F. & Suárez, J. A. (2006). Effects of pH, temperature and SO2 on the formation of pyranoanthocyanins during red wine fermentation with two species of Saccharomyces. International Journal of Food Microbiology, 106, 123-129.
Morata, A., Gómez-Cordovés, M.C., Colomo B. & Suárez, J.A. (2003). Pyruvic acid and acetaldehide production by different strains of Saccharomyces cerevisiae: relationship with vitisin A and B formation in red wines. Journal of Agriculture and. Food Chemistry. 51, 6475-6481.
Morata, A.; Calderón, F.; Colomo, B.; González, M. C.; Suárez-Lepe, J.A. (2005). Release of polysaccharydes in a model médium by selected yeasts, and the effect of adding β-glucanases. In Vino Analytica Scientia. Montepellier, France, 7-9 July, 2005.
Pellerin, P. & Tessarolo, L. (2001). Optimizing the ageing of wines on lees. Australian Grapegrower and Winemaker. 444, 14-15.
Pretorius, I. S. (2000). Tailoring wine yeast for the new millennium: novel approaches to the ancient art of winemaking. Yeast, 16, 675-729.
Pueyo, E., Martínez-Rodríguez, A., Polo, M.C., Santa-María, G. & Bartolomé, B. (2000). Release of lipidsduring yeast autolysis in a model wine system. Journal of Agriculture and. Food Chemistry. 46, 116-122.
Romero, C. & Bakker, J. (2000). Anthocyanin and colour evolution during maturation of port wines: effect of pyruvic acid adition. Journal of the Science of Food and Agriculture. 81, 252-260.
Rosenfeld, E., Beauvoit, B., Blondin, B. & Salmon, J.M. (2003). Oxygen consumption by anaerobic Saccharomyces cerevisiae in enological conditions: effect on fermentation kinetics. Applied and Environmental Microbiology. 69, 113-121.
Salmon, J.M. (2005). Interactions between yeast, oxygen and polyphenols during alcoholic fermentations: practical implications. LWT-Food Science and Technology. 39, 959-965.
Sato, M., Suzuki, Y., Hanamure, K., Katoh, I., Yagi, Y. & Otsuka, K. (1997). Winemaking from koshu variety by the sur lie method: behavior of free amino acids and proteolytic activities in the wine. American Journal of Enology and Viticulture. 1, 1-6.
Saucier, C., Little, D. & Glories, Y. (1997). First evidence of acetaldehyde-flavanol condensation products in red wine. American Journal of Enology and Viticulture. 48, 370-374.
Suzzi, G. (1990). La capacità autolitica come carattere di selezione in Saccharomyces cerevisiae. Industries delle Bevande. 19, 318-321.
Trione, D. & Martínez, A. (2001). Elevage sur lies des vins rouges: la voie enzymatique. Revue des. Oenologues. 101, 19-21.
Vivas, N., Saint Cricq de Gaulejac, N. (2000). L`enjeu œnologique de l`elevage sur lie des vins rouges. II. Propriérités et modes de valorisation. Connaissances actuelles & Avenir de l`elevage en barriques (Special issue). Journal des Sciences et Techniques de la Tonnellerie. 43-46.
Wightman, J. D. & Wrolstad, R. E. (1996). Β-glucosidase activity in juice-processing enzymes based on anthocyanin analysis. Journal of Food Science. 61, 544-552.
Wrolstad, R. E., Wightman, J. D. & Durst, R. W. (1994). Glycosidase activity of enzyme preparations used in fruit processing. Food Technology, 11, 90-98.