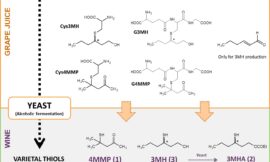
Podríamos decir que la complejidad molecular del vino está aún por desvelar. Tradicionalmente se habla del vino como un alimento complejo en cuya composición entran a formar parte más de mil compuestos distintos. Sin embargo, los primeros análisis metabolómicos indican la posibilidad de detectar más de 4000 moléculas distintas, entre las cuales se encuentran algunas cuyos niveles pueden correlacionarse positiva o negativamente con su calidad1 Esta cantidad de compuestos puede ser aún mayor si se considera globalmente la gran diversidad de tipos de vinos existentes. Una gran parte de estas moléculas tienen su origen en precursores que se hallan en la uva y, por ello, la elaboración de un vino de calidad requiere una uva en óptimos estados sanitario y de maduración. Como se verá en los siguientes artículos, esta complejidad también depende del proceso de elaboración del vino aplicado a la uva o al mosto y de los sucesivos procesos fermentativos y de crianza de los vinos.

La vid silvestre (Vitis vinifera L.) es una liana común en los bosques de ribera y cuya área de distribución se extiende por todas las regiones templadas de Eurasia. Se estima que los primeros sucesos de domesticación se produjeron hace más de 8000 años, pero dado el carácter originalmente dioico de la especie (plantas masculinas y femeninas) y su multiplicación vegetativa, las variedades que han llegado a nuestros días son altamente heterocigóticas y mantienen una gran diversidad genética (fig. 1). Podríamos decir que cada variedad de vid es un genotipo irrepetible que la viticultura ha mantenido a lo largo de los años mediante propagación vegetativa.2
La vid produce frutos de tipo baya organizados en racimos. De modo similar a otras bayas, el proceso de desarrollo y maduración de la uva ha adoptado una serie de mecanismos durante la evolución dirigidos a favorecer la dispersión animal de las semillas y asegurar la propagación de la especie. Con este objetivo, los frutos de la vid, inicialmente pequeños, poco atractivos, astringentes y de sabor ácido, se convierten, una vez desarrolladas las semillas, en frutas de color atractivo y de sabor dulce que permiten la alimentación de las aves y mamíferos que dispersan sus semillas.3
Estructura y desarrollo de la uva
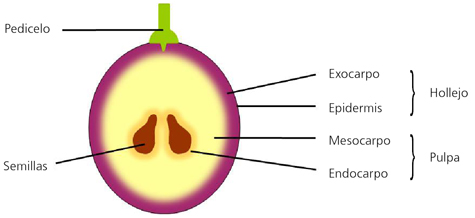
En la estructura de la uva se pueden distinguir dos partes claramente diferenciadas, las semillas y el pericarpo o conjunto de tejidos que las envuelve (fig. 2). Las semillas se desarrollan a partir de los óvulos tras su doble fecundación, mientras que el pericarpo es el resultado del crecimiento y diferenciación de la pared del ovario. En el pericarpo pueden distinguirse tres tipos de tejidos, organizados concéntricamente alrededor de las semillas, el endocarpo más interno y con una textura más gelatinosa, el mesocarpo intermedio y que ocupa el mayor volumen de la baya y el exocarpo más externo que contiene la epidermis recubierta por una cutícula cérea y algunas capas celulares subepidérmicas.3,5 Comúnmente, el exocarpo se conoce como hollejo y el mesocarpo junto con el endocarpo forman lo que se denomina la pulpa de la baya (fig. 2).
El desarrollo de la uva presenta dos períodos de crecimiento sigmoidal separados por una fase de latencia en la que no hay cambio de tamaño (fig. 3). La primera fase de crecimiento del fruto se inicia tras la polinización de las flores y se denomina cuajado. Durante esta fase las células del ovario de la flor que darán lugar al fruto se dividen para generar la estructura de la baya y se inicia el desarrollo de las semillas. El tamaño del fruto aumenta durante esta fase como consecuencia de la división y expansión celular. Al final de esta fase, los frutos son verdes y duros y han alcanzado un tamaño entre un guisante y una aceituna, dependiendo de la variedad. El número de células que tendrá el fruto maduro queda prácticamente establecido en esta fase y la baya entra en una fase de latencia en la que su crecimiento se estanca.
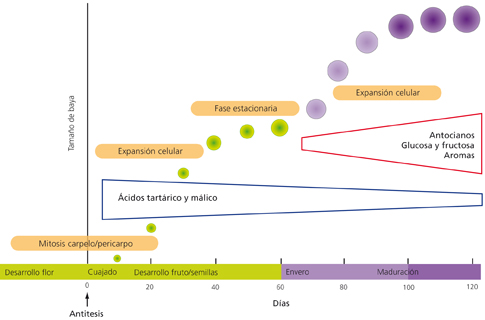
La segunda fase de crecimiento corresponde al proceso de maduración y se inicia con el envero una vez culminado el desarrollo de las semillas. El envero se caracteriza por la acumulación de color (en las uvas tintas), el ablandamiento del fruto y un cambio radical en su composición. Posteriormente, los frutos continúan creciendo y pueden llegar a duplicar su tamaño. Sin embargo, este aumento se debe exclusivamente a la expansión celular asociada con la acumulación de agua y azucares solubles.4-6 Como veremos, es a partir del envero cuando se producen los cambios más relevantes en la composición del fruto desde un punto de vista enológico.7
Composición química de la baya y su aportación al vino
Los diferentes tejidos que forman el fruto contribuyen de manera diferencial a la composición final del mosto y del vino. La pulpa aporta el agua que constituye entre un 80-90 % del volumen del vino y componentes mayoritarios del metabolismo primario como son los azúcares glucosa y fructosa y los ácidos orgánicos, fundamentalmente los ácidos málico y tartárico. Durante la fase de maduración, el fruto se convierte en un sumidero de fotoasimilados. La sacarosa que se importa de las hojas es transformada en el fruto en las hexosas glucosa y fructosa que se acumulan en las vacuolas de las células de la pulpa.4,8 Ambas serán transformadas en su mayor parte en etanol durante la fermentación generada por las levaduras, por lo que el contenido en azúcares de la uva determinará el grado alcohólico final del vino. Por su parte, los ácidos málico y tartárico constituyen más del 90% de los ácidos orgánicos del fruto y su concentración determina la acidez total de la uva. El ácido málico se acumula a niveles muy elevados en las uvas verdes y su contenido se reduce drásticamente durante la maduración. Por el contrario, los niveles de ácido tartárico permanecen bastante constantes después del envero y suelen ser elevados en las uvas maduras.9,10 Una acidez moderada y un pH bajo son factores muy importantes en los vinos de calidad, dado que son necesarios para asegurar una buena crianza del vino y contribuyen de forma muy importante a su color y a su equilibrio gustativo.4 Finalmente, es importante mencionar el proceso de ablandamiento de la pulpa que tiene lugar durante la maduración de la uva que se asocia con un incremento en la actividad de enzimas pectina metil esterasas y que tiene una gran importancia en la elaboración del vino.
El hollejo contribuye con un gran número de compuestos del metabolismo secundario que en su conjunto aportan al vino características varietales. Entre ellos merece la pena mencionar los compuestos fenólicos solubles que contribuyen al color y al sabor del vino y los compuestos aromáticos que contribuyen al sabor y al aroma.4,11 Entre los compuestos fenólicos solubles se distinguen tanto flavonoides como no flavonoides.12 Entre los primeros se encuentran los antocianos, que son los pigmentos responsables del color de la uva y del vino tinto y rosado. Todas las variedades con uvas coloreadas de la especie Vitis vinifera, con la excepción de unos pocos genotipos tintoreros, acumulan antocianos en el hollejo pero no en la pulpa.13 Por ello, todos sus mostos son blancos y la elaboración de vinos tintos requiere la maceración de los mostos junto con los hollejos de las uvas tintas para extraer sus pigmentos. Otros flavonoides relevantes son los flavanoles o catequinas en sus formas libres o polimerizadas que confieren sabor amargo y astringencia al vino y por lo tanto contribuyen de manera importante a la percepción de su estructura en la boca. Estos flavonoides se encuentran tanto en los hollejos como en las semillas y son particularmente importantes en los vinos tintos porque su proceso de elaboración implica la maceración del mosto con hollejos y semillas.12,14 Igualmente entre los flavonoides cabe también mencionar a los taninos o polímeros complejos de ácidos fenólicos o protoantocianidinas con efectos organolépticos similares a las catequizas.15 Los taninos se sintetizan durante estadios tempranos del desarrollo de la baya y de la semilla y posteriormente, durante la maduración, sufren reacciones de polimerización. Entre los compuestos fenólicos no flavonoides merece la pena citar los estilbenos entre los que se encuentra el resveratrol, conocido por su elevado poder antioxidante, y diversos compuesto fenólicos volátiles que confieren aromas al vino.12
Por su parte, el hollejo y también la pulpa contribuyen al aroma del vino que viene determinado por cientos de metabolitos secundarios presentes en la baya en concentraciones variables, pero también por metabolitos y compuestos derivados de los procesos de extracción y tratamiento del mosto, de los procesos de fermentación o de los procesos de crianza en barrica. Los metabolitos aromáticos volátiles o conjugados derivados de la uva, son los que aportan las características varietales del vino. Entre ellos, una de las familias más importantes es la de los terpenos con compuestos como linalool, terpineol o geraniol que confieren aromas frutales y en especial el conocido aroma moscatel.16,17 Los norisoprenoides como la ß-damascenona con aromas de frutas tropicales o la ß-ionona responsable del aroma de violetas. Moléculas de cadenas hidrocarbonadas de 6 carbonos que se acumulan en la uva y son precursores de ésteres de acetato también aromáticos que se producen durante la fermentación.18 Las metoxipirazinas, derivadas del metabolismo de aminoácidos confieren aromas de pimiento en algunas variedades, sobre todo en las uvas inmaduras. Esas pirazinas, no deseables en algunos casos, como en los vinos tintos de cabernet sauvignon, confieren característicos aromas varietales en otras ocasiones como en los vinos blancos de sauvignon blanc, junto con compuestos azufrados.19 En general, la identificación del estado de madurez óptimo de la uva para su vinificación persigue la disminución de los compuestos aromáticos acumulados en altos niveles en uvas verdes que contribuyen negativamente en la calidad al aportar notas herbáceas al vino.20
Muchos de los compuestos volátiles del vino que proceden de la uva se acumulan en esta como compuestos solubles más estables, la mayoría en forma de conjugados glucosídicos en el caso de los terpenos o aminoácidicos en el de los tioles.4 Durante el proceso de vinificación se produce la hidrólisis de los conjugados lo cual permite la volatilización de los aromas.
Finalmente el exocarpo de la piel y en menor medida el endocarpo acumulan proteínas que por un lado sirven como fuente de nitrógeno para el proceso de fermentación y que en parte persisten en el vino afectando a su sabor, claridad y estabilidad. Generalmente las proteínas más abundantes en la uva están relacionadas con las respuestas a patógenos, aunque también se identifican perfiles de proteínas característicos dependiendo de la variedad.21
Factores que determinan la composición final de la baya
La composición final de la baya depende del genotipo de la variedad, de las condiciones ambientales (clima, suelo y manejo del cultivo) y de la interacción entre genotipo y ambiente. Entre todos estos factores es el genotipo el que en la mayor parte de los análisis explica un mayor porcentaje de la variación en la composición. De hecho, el genotipo no solo determina la composición final de la baya sino que al especificar otras características varietales como las fechas de brotación, floración o maduración, la estructura y compacidad del racimo, el tamaño de la baya, el grosor del hollejo o la producción final, está también afectando indirectamente a la composición final del fruto. El genotipo de la variedad determina, por ejemplo, que el hollejo de la baya acumule o no antocianos y por lo tanto produzca uvas tintas o blancas, que acumule altos niveles de monoterpenos y desarrolle un pronunciado sabor moscatel o de metoxipirazinas con los efectos negativos de un intenso aroma a pimiento verde.22-24 Por otra parte, los racimos menos compactos presentan uvas más expuestas a la luz y las uvas más pequeñas tienen una mayor proporción hollejo/pulpa lo que en ambos casos aporta una mayor contribución a la intensidad de color del vino.
El ambiente y las condiciones de cultivo tienen efectos cuantitativos sobre los procesos de desarrollo y maduración de la baya y sobre la actividad del metabolismo secundario. Concretamente, la temperatura afecta directamente a la velocidad de reacciones enzimáticas y químicas y puede acelerar o ralentizar la síntesis o la degradación de distintos metabolitos. Este es el caso del ácido málico cuya metabolización se acelera con la temperatura o de los azúcares cuya concentración en la baya aumenta por la deshidratación que provocan las altas temperaturas, lo que en conjunto resulta en vinos más alcohólicos y desequilibrados en acidez. Para evitar estos efectos se tiende a adelantar la cosecha, con lo que se empobrece la madurez fenólica y aromática.4,25,26 La temperatura elevada también tiene un efecto negativo sobre la acumulación de pigmentos antociánicos reduciendo la intensidad del color del vino.27 También la intensidad y calidad de la luz a la que están expuestas las uvas tienen un importante efecto en el metabolismo secundario.28,29 y algunas prácticas vitícolas como el tipo de conducción o el deshojado tratan de mejorar la exposición de las uvas a la luz para conseguir estos efectos.27 Concretamente, un aumento de la exposición a la radiación solar aumenta el contenido de aromas terpénicos de las uvas y disminuye los niveles de metoxipirazinas. De la misma manera, la exposición a la luz ultravioleta en viñedos de altura o en zonas con menor capa de ozono tiene un efecto positivo en la acumulación de flavonoles como la quercetina, de resveratrol y de antocianos.30 La disponibilidad de agua es otro componente ambiental que también afecta la composición final de la uva y en general se considera que un estrés hídrico moderado aumenta la concentración de metabolitos secundarios en la uva y tiene por tanto efectos positivos en el color, en el contenido aromático de la uva y en la acumulación de estilbenos.26,31-34 La presencia de patógenos o plagas también puede desencadenar o provocar efectos cuantitativos en distintas rutas del metabolismo secundario con los efectos mencionados en la concentración de algunos metabolitos secundarios. Finalmente, las condiciones ambientales modulan la producción y el desarrollo de los frutos y este proceso afecta también indirectamente a su composición.26 Así, por ejemplo, la compacidad del racimo está directamente relacionada con la tasa de cuajado que a su vez depende de la eficacia de la polinización y del aborto del desarrollo de las semillas. Por tanto, el estado de desarrollo de la planta durante el período de floración y las condiciones ambientales y de cultivo afectará a la irradiación que reciben las uvas durante la maduración y consecuentemente a su composición y a su sensibilidad a enfermedades y plagas del racimo.
La mayor parte de los efectos ambientales mencionados muestran una gran interacción con el genotipo y poco a poco se van identificando variedades que son más sensibles que otras a determinadas condiciones ambientales en cada uno de los procesos que intervienen en el desarrollo de la planta y del fruto. Este es el caso del déficit hídrico, que afecta diferencialmente a genotipos isohídricos o anisohídricos que difieren en su capacidad de regular el estado hídrico de la planta, lo cual también repercute en el efecto de esta condición sobre el desarrollo y la composición de la uva.31
En resumen, la complejidad del proceso de desarrollo y maduración de la uva es, en gran parte, responsable de la diversidad y complejidad de los vinos. En esta complejidad participa un componente genético o varietal muy importante y componentes ambientales y de interacción genotipo–ambiente nada despreciables que contribuyen a la variación entre añadas y zonas geográficas.
Bibliografía
1. Cuadros-Inostroza, A., Giavalisco, P., Hummel, J., Eckardt, A., Willmitzer, L. and Peña-Cortés, H. (2010) Discrimination of Wine Attributes by Metabolome Analysis. Analytical Chemistry 82: 3573-3580.
2. This, P., Lacombe, T. and Thomas, M.R. (2006) Historical origins and genetic diversity of wine grapes. Trends Genet 22: 511-519.
3. Hardie, W.J., O’Brien, T.P. and Jaudzems, V.G. (1996) Morphology, anatomy and development of the pericarp after anthesis in grape, Vitis vinifera L. Aust J Grape Wine Res 2: 97-142.
4. Conde, C., Silva, P., Fontes, N., Dias, A.C.P., Tavares, R.M., Sousa, M.J., et al. (2007) Biochemical Changes throughout Grape Berry Development and Fruit and Wine Quality. Food 1: 1-22.
5. Pratt, C. (1971) Reproductive Anatomy in Cultivated Grapes – A Review. American Journal of Enology and Viticulture 22: 92-109.
6. Coombe, B.G. and McCarthy, M.G. (2000) Dynamics of grape berry growth and physiology of ripening. Aust J Grape Wine Res 6: 131-135.
7. Dai, Z.W., Leon, C., Feil, R., Lunn, J.E., Delrot, S. and Gomes, E. (2013) Metabolic profiling reveals coordinated switches in primary carbohydrate metabolism in grape berry (Vitis vinifera L.), a non-climacteric fleshy fruit. J Exp Bot 64: 1345-1355.
8. Robinson, S.P. and Davies, C. (2000) Molecular biology of grape berry ripening. Aust J Grape Wine Res 6: 175-188.
9. Possner, D.R.E. and Kliewer, W.M. (1985) The localisation of acids, sugars, potassium and calcium in developing grape berries. Vitis 24: 229-240.
10. Ruffner, H.P. (1982) Metabolism of tartaric and malic acids in Vitis: A review, Part B. Vitis 21: 346-358.
11. Lund, S.T. and Bohlmann, J. (2006) The molecular basis for wine grape quality–a volatile subject. Science 311: 804-805.
12. Waterhouse, A.L. (2002) Wine phenolics. Ann N Y Acad Sci 957: 21-36.
13. He, F., Mu, L., Yan, G.L., Liang, N.N., Pan, Q.H., Wang, J., et al. (2010) Biosynthesis of anthocyanins and their regulation in colored grapes. Molecules 15: 9057-9091.
14. Kennedy, J.A., Matthews, M.A. and Waterhouse, A.L. (2000) Changes in grape seed polyphenols during fruit ripening. Phytochemistry 55: 77-85.
15. Vidal, S., Francis, L., Guyot, S., Marnet, N., Kwiatkowski, M., Gawel, R., et al. (2003) The mouth-feel properties of grape and apple proanthocyanidins in a wine-like medium. J Sci Food Agric 83: 564-573.
16. Luan, F. and Wust, M. (2002) Differential incorporation of 1-deoxy-D-xylulose into (3S)-linalool and geraniol in grape berry exocarp and mesocarp. Phytochemistry 60: 451-459.
17. Ribereau-Gayon, P., Boidron, J.N. and Terrier, A. (1975) Aroma of Muscat grape varieties. J Agric Food Chem 23: 1042-1047.
18. Dennis, E.G., Keyzers, R.A., Kalua, C.M., Maffei, S.M., Nicholson, E.L. and Boss, P.K. (2012) Grape contribution to wine aroma: production of hexyl acetate, octyl acetate, and benzyl acetate during yeast fermentation is dependent upon precursors in the must. J Agric Food Chem 60: 2638-2646.
19. Polaskova, P., Herszage, J. and Ebeler, S.E. (2008) Wine flavor: chemistry in a glass. Chem Soc Rev 37: 2478-2489.
20. Kalua, C.M. and Boss, P.K. (2009) Evolution of volatile compounds during the development of cabernet sauvignon grapes (Vitis vinifera L.). J Agric Food Chem 57: 3818-3830.
21. Flamini, R. and De Rosso, M. (2006) Mass spectrometry in the analysis of grape and wine proteins. Expert Rev Proteomics 3: 321-331.
22. Battilana, J., Emanuelli, F., Gambino, G., Gribaudo, I., Gasperi, F., Boss, P.K., et al. (2011) Functional effect of grapevine 1-deoxy-D-xylulose 5-phosphate synthase substitution K284N on Muscat flavour formation. J Exp Bot 62: 5497-5508.
23. Koch, A., Doyle, C.L., Matthews, M.A., Williams, L.E. and Ebeler, S.E. (2010) 2-Methoxy-3-isobutylpyrazine in grape berries and its dependence on genotype. Phytochemistry 71: 2190-2198.
24. Lijavetzky, D., Ruiz-Garcia, L., Cabezas, J.A., De Andres, M.T., Bravo, G., Ibanez, A., et al. (2006) Molecular genetics of berry colour variation in table grape. Mol Genet Genomics 276: 427-435.
25. Jones, G.V., White, M.A., Cooper, O.R. and Storchmann, K. (2005) Climate Change and Global Wine Quality. Climatic Change 73: 319-343.
26. Keller, M. (2010) Managing grapevines to optimise fruit development in a challenging environment: a climate change primer for viticulturists. Aust J Grape Wine Res 16: 56-69.
27. Downey, M.O., Dokoozlian, N.K. and Krstic, M.P. (2006) Cultural Practice and Environmental Impacts on the Flavonoid Composition of Grapes and Wine: A Review of Recent Research. Am J Enol Vitic 57: 257-268.
28. Czemmel, S., Stracke, R., Weisshaar, B., Cordon, N., Harris, N.N., Walker, A.R., et al. (2009) The grapevine R2R3-MYB transcription factor VvMYBF1 regulates flavonol synthesis in developing grape berries. Plant Physiol 151: 1513-1530.
29. Koch, A., Ebeler, S.E., Williams, L.E. and Matthews, M.A. (2012) Fruit ripening in Vitis vinifera: light intensity before and not during ripening determines the concentration of 2-methoxy-3-isobutylpyrazine in Cabernet Sauvignon berries. Physiol Plant 145: 275-285.
30. Koyama, K., Ikeda, H., Poudel, P.R. and Goto-Yamamoto, N. (2012) Light quality affects flavonoid biosynthesis in young berries of Cabernet Sauvignon grape. Phytochemistry 78: 54-64.
31. Chaves, M.M., Zarrouk, O., Francisco, R., Costa, J.M., Santos, T., Regalado, A.P., et al. (2010) Grapevine under deficit irrigation: hints from physiological and molecular data. Ann Bot 105: 661-676.
32. Deluc, L.G., Decendit, A., Papastamoulis, Y., Merillon, J.M., Cushman, J.C. and Cramer, G.R. (2011) Water deficit increases stilbene metabolism in Cabernet Sauvignon berries. J Agric Food Chem 59: 289-297.
33. Deluc, L.G., Quilici, D.R., Decendit, A., Grimplet, J., Wheatley, M.D., Schlauch, K.A., et al. (2009) Water deficit alters differentially metabolic pathways affecting important flavor and quality traits in grape berries of Cabernet Sauvignon and Chardonnay. BMC Genomics 10: 212.
34. Koundouras, S., Hatzidimitriou, E., Karamolegkou, M., Dimopoulou, E., Kallithraka, S., Tsialtas, J.T., et al. (2009) Irrigation and rootstock effects on the phenolic concentration and aroma potential of Vitis vinifera L. cv. cabernet sauvignon grapes. J Agric Food Chem 57: 7805-7813.
Lecturas recomendadas
Conde, C., Silva, P., Fontes, N., Dias, A.C.P., Tavares, R.M., Sousa, M.J., et al. (2007) Biochemical Changes throughout Grape Berry Development and Fruit and Wine Quality. Food 1: 1-22.
Keller, M. (2010) Managing grapevines to optimise fruit development in a challenging environment: a climate change primer for viticulturists. Aust J Grape Wine Res 16: 56-69.
Polaskova, P., Herszage, J. and Ebeler, S.E. (2008) Wine flavor: chemistry in a glass. Chem Soc Rev 37: 2478-2489.
This, P., Lacombe, T. and Thomas, M.R. (2006) Historical origins and genetic diversity of wine grapes. Trends Genet 22: 511-519.
Waterhouse, A.L. (2002) Wine phenolics. Ann N Y Acad Sci 957: 21-36