Introducción
Por diversas causas entre las que destacan los efectos del cambio climático, en los últimos años la industria enológica ha sufrido una transformación importante, convirtiéndose en un sector de constantes cambios e innovaciones. Las dificultades para llevar a cabo la fermentación maloláctica (FML) por parte de las bacterias lácticas (BL) han promovido el estudio, desarrollo y mejora de diferentes tecnologías para llevar a cabo este proceso con éxito. El control eficiente de la FML requiere un amplio conocimiento de la respuesta de las BL a las actuales condiciones de estrés que se encuentran en el mosto y en el vino.1
La capacidad de las BL para realizar la FML está influenciada por muchos factores entre los que se incluyen el pH, la temperatura, el contenido de inhibidores del crecimiento (etanol, SO2, ácidos grasos de cadena media, etc.), la escasez de nutrientes, las cepas de levadura que realizan la fermentación alcohólica (FA) y las diferentes interacciones entre las especies que forman la microbiota autóctona.2,4 La supervivencia de las bacterias malolácticas en el vino bajo tales condiciones de estrés requiere el mantenimiento de la funcionalidad de la membrana celular para poder controlar la permeabilidad iónica y regular el intercambio de solutos y nutrientes entre el interior celular y el medio externo.1 Entre los factores de estrés mencionados, el etanol se considera el más decisivo porque daña la membrana celular afectando gravemente a su integridad y por tanto a la viabilidad bacteriana.5 Tras el etanol, el segundo factor de estrés más importante que afecta a las BL durante el proceso de vinificación es el pH.1
El cambio climático modifica el desarrollo de la vid y los perfiles de maduración del fruto. El aumento de la temperatura ambiente afecta a la acidez total, el pH de los mostos y una alta concentración de azúcar de los mostos, lo que implica vinos de baja acidez, y valores de pH y etanol altos debido a la sobremaduración.6,7 La mayoría de los vinos tienen un pH que oscila entre 3,2 y 3,8, pero puede llegarse fácilmente hoy en día a valores inferiores a 3,0 o superiores a 4,0.8-11 Por debajo de 3,2, en vinos muy ácidos, la FML es particularmente difícil debido a dos factores principales: por un lado, el estrés que supone el propio valor de pH en sí mismo y las dificultades que implica para un mantenimiento adecuado del intracelular de las bacterias; por otro, porque supone un efecto sinérgico negativo con otros factores, especialmente el sulfuroso (mayor cantidad de SO2 libre y molecular a pH bajos). Sin embargo, cuanto mayor es el pH, la realización de la FML es más fácil, pero el inconveniente radica en que mayor variedad de bacterias serán capaces de desarrollarse, ya que más favorables son las condiciones para el crecimiento bacteriano y la consiguiente posible alteración de los mostos y vinos.
«En la actualidad, los vinos con baja acidez total y elevado pH son cada vez más frecuentes debido al cambio climático.»
Aunque Oenococcus oeni se ha considerado la especie predominante durante la FML espontánea, no es la única. Los vinos con un pH próximo a 4,0 permiten el desarrollo de BL y bacterias y levaduras no deseadas, así como la formación de compuestos tóxicos como aminas biógenas.2,12,13 En la actualidad, los vinos con baja acidez total y elevado pH son cada vez más frecuentes debido al cambio climático. En el otro extremo, el uso cada vez mayor de variedades de uva de bajo pH en la vinificación y el interés en la realización de la FML en vinos blancos y espumosos hace que encontremos vinos de pH bajo en los que es muy difícil llevar a cabo la FML. En ambos casos es necesario un control muy exhaustivo de la microbiota que realizará la fermentación y la elección correcta de la estrategia de inoculación.
Esta revisión se centra en resumir una considerable cantidad de investigación que se ha dirigido en los últimos años hacia la mejora de la eficiencia y la fiabilidad de la FML en condiciones difíciles, especialmente en vinos que presentan niveles de pH extremos, muy altos o muy bajos. Se discuten los impedimentos para el desarrollo de la FML y se presta atención a cómo mejorar el éxito de la misma a través de diferentes estrategias de inoculación y mediante el uso de diferentes especies microbianas. También se proporciona una actualización de cómo se puede usar esta información para mejorar los resultados sensoriales durante la FML y sugerencias para futuras prioridades de investigación en este campo.
Estrategias para llevar a cabo la fermentación maloláctica en vinos con pH elevado
Debido al cambio climático, el pH del vino ha aumentado gradualmente durante los últimos años y los vinos con niveles de pH superiores a 3,5–3,6 son cada vez más frecuentes. La fuerte disminución de la acidez total en los vinos tiene un gran impacto en la calidad del mismo, generando defectos en la calidad sensorial (por ejemplo, sabor menos ácido, cambios en el color, etc.) y favoreciendo el crecimiento de microorganismos no deseables (reduciendo la estabilidad del vino).6,12
Los valores superiores a pH 3,5 favorecen el crecimiento de especies como Lactobacillus y Pediococcus spp., mientras que O. oeni tiende a dominar a valores de pH más bajos.14 Esto ha impulsado que en los últimos años numerosos autores respalden el uso de cultivos iniciadores alternativos a O. oeni para el desarrollo de la FML.10,15,16 En la tabla 1 se muestra una descripción general de las estrategias y las especies microbianas utilizadas para desarrollar la FML en estas condiciones de pH. La especie Lactobacillus plantarum ha sido proclamada como una candidata adecuada para ser utilizada como cultivo iniciador para la FML ya que puede sobrevivir bajo condiciones de vinificación y posee muchas propiedades de interés tecnológico.17
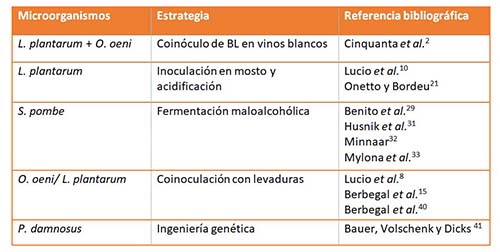
De hecho, durante el proceso de fermentación también puede llevar a cabo una serie de reacciones metabólicas secundarias de gran importancia para la formación de aromas en vinos,18,19 y exhibe un rango más amplio y mayor espectro de actividades enzimáticas que O. oeni.17,20 Cinquanta et al. estudiaron el efecto del pH en dos vinos italianos (falanghina y tintilia) inoculados con O. oeni, con L. plantarum o con una mezcla 50:50 de ambos.2 La duración de la FML estuvo influenciada por el pH y la cepa de BL utilizada. Ambas especies fueron capaces de completar la FML a pH 3,8, aunque no fueron capaces de completarla a pH 3,2. La cepa de L. plantarum mejoró las notas florales en los vinos blancos de falanghina y mostró un buen impacto organoléptico en los vinos tintos de tintilia, cuya intensidad sensorial se mejoró con una mezcla comercial (50:50) de O. oeni y L. plantarum.
Además se ha propuesto el uso de L. plantarum como método de acidificación biológica debido a su capacidad para producir altas concentraciones de ácido láctico.10,21 En esta línea, numerosas investigaciones van dirigidas a la selección y caracterización de cepas de L. plantarum para ser inoculadas en mosto.10,15,22 Una inoculación temprana en el proceso de vinificación es, además, aconsejable por la incapacidad de L. plantarum de crecer en presencia de más del 8% de etanol, de acuerdo con varios autores.15,23 Una de las ventajas de la coinoculación levaduras-bacterias en mosto es que no se sintetiza etanol en las primeras etapas de vinificación. Por lo tanto, se puede usar una BL más sensible, como L. plantarum, en lugar de O. oeni.20 Incluso a veces es posible programar la coinoculación de una mezcla de diferentes BL (L. plantarum y O. oeni) con levaduras para completar la FML de manera más rápida y segura.24 Otra ventaja de usar L. plantarum es que este organismo es homofermentativo para la glucosa,25 lo que evita el riesgo de aumentar la acidez volátil. La evidencia reciente sugiere el uso adicional de cepas seleccionadas de L. plantarum para la acidificación prealcohólica del mosto de uva.9,10,15,21,26-28 Lucio et al. realizaron una selección de cepas de Lactobacillus utilizando diversos criterios entre los que se priorizó la capacidad y eficiencia de crecimiento en mosto.10 Los resultados mostraron que cepas que crecían en mosto realizaron la FML, acidificaron el mosto, sintetizaron ácido láctico a partir de los azúcares y mostraron alta resistencia a la lisozima y al sulfuroso. Onetto et al. plantearon el uso de L. plantarum para reducir el pH a través de la acidificación del mosto previamente a la realización de la FA por parte de las levaduras.21 En su investigación, los azúcares disponibles fueron consumidos por las BL produciendo hasta 8,3 g/L de ácido láctico. El ácido láctico cambió el pH de 3,9 a 3,4 después de 14 días sin producirse concentraciones relevantes de ácido acético (0,34 g/L).
Una estrategia alternativa al uso de L. plantarum es la inoculación de levaduras no Saccharomyces, concretamente cepas de Schizosaccharomyces pombe para la disminución de la acidez mediante la fermentación maloalcohólica. La desacidificación biológica es posible gracias a la capacidad de esta levadura de consumir el ácido málico presente en el mosto o en el vino con la producción estequiométrica correspondiente de etanol y CO2.29,30 Para este objetivo, diferentes cepas de Schizosaccharomyces spp. han sido inmovilizadas en perlas de alginato,31 coinoculadas con S. cerevisiae o inoculadas secuencialmente.32,33 Sin embargo, hay que tener presente también que S. pombe se considera una levadura peligrosa debido a la producción de sabores desagradables asociados a su metabolismo. S. pombe se aísla comúnmente de vinos con deficiencias organolépticas y químicas y en los que se encuentran concentraciones importantes de ácido acético, acetaldehído, acetoína y acetato de etilo.33-35
Asimismo, es importante resaltar que en mostos de pH alto se observa un crecimiento muy rápido de microorganismos autóctonos, algunos de los cuales son considerados como microorganismos alterantes que pueden causar compuestos indeseables que afectan negativamente al vino, como por ejemplo la formación de fenoles volátiles o compuestos tóxicos para los humanos, como las aminas biógenas o micotoxinas.36 Para limitar el desarrollo de esta microbiota autóctona no deseada se recomienda la coinoculación de bacterias malolácticas seleccionadas (O. oeni/L. plantarum) junto con las levaduras responsables de la FA. Para llevar a cabo esta estrategia es necesario tener en cuenta la compatibilidad de las BL con las cepas seleccionadas de levadura,8,15,37,38 y se recomienda el empleo de cultivos iniciadores autóctonos por estar bien adaptados a las condiciones de un área vitivinícola específica.39 En cuanto a O. oeni, se ha visto que la coinoculación en mosto junto a cepas compatibles de S. cerevisiae evita el desarrollo de levaduras no deseadas como Brettanomyces bruxellensis. Berbegal et al. coinocularon diferentes cepas de S. cerevisiae, levaduras no Saccharomyces y O. oeni utilizando diferentes estrategias.40 Cuando se coinocularon S. cerevisiae y O. oeni en mosto de la variedad nero di Troia contaminado con B. bruxellensis, los resultados mostraron una disminución en 4-etil guayacol y 4-etil fenol por debajo de su umbral de percepción sensorial tras 21 días del comienzo de la FA. Curiosamente, la población de B. bruxellensis también se redujo en presencia de O. oeni.40
Lucio et al. estudiaron las consecuencias de las interacciones de diferentes combinaciones entre dos cepas de L. plantarum y seis cepas comerciales de S. cerevisiae.8 Los resultados mostraron que fue posible controlar la acidez del vino coinoculando L. plantarum y S. cerevisiae. La FML se llevó a cabo con cualquier combinación BL/levadura, pero el grado de acidificación biológica dependió de la combinación de cepas utilizadas. Las investigaciones de Berbegal et al. mostraron que la coinoculación de S. cerevisiae y L. plantarum en mosto mejoraba la adaptación de las BL a las duras condiciones del vino.15 El procedimiento propuesto puede generalizarse como un método estándar para el diseño de cultivos iniciadores de MLF adaptados para mostos de pH alto.
Además del género Lactobacillus, Pediococcus sp. es capaz de realizar la FML a pH elevados. Sin embargo, algunos pediococos sintetizan polisacáridos extracelulares, lo que puede conducir a la presencia de una viscosidad anormal en el vino. Una forma de solucionar este tipo de problemas es mediante ingeniería genética. Bauer et al. clonaron el gen maloláctico de Pediococcus damnosus NCFB1832 (mleD) en S. cerevisiae.41 La cepa genéticamente modificada de S. cerevisiae fue capaz de disminuir el nivel de ácido málico en mosto a menos de 0,3 g/L en 3 días.
Por otro lado, estudios recientes muestran que la supervivencia bacteriana está más relacionada con la evolución del pH durante la FML que con el pH inicial del mosto. Lerena et al. realizaron una evaluación de la capacidad de un nuevo cultivo iniciador de L. plantarum para completar la FML a escala de laboratorio y semiindustrial.42 En todos los casos, los mostos mostraron valores de pH iniciales superiores a 3,6, pero el pH mostró un comportamiento dinámico, cambiando a medida que avanzaba el FML. En fermentaciones en las que el pH aumentó con el tiempo, la cepa de L. plantarum metabolizó con éxito la mayoría del ácido málico que estaba presente originalmente en el mosto. Por el contrario, cuando el pH fue disminuyendo con el tiempo, los recuentos bacterianos se redujeron, al igual que la tasa de consumo de ácido málico.
Estrategias para llevar a cabo la fermentación maloláctica en vinos con pH bajo
El uso cada vez mayor de variedades de uva de bajo pH en la vinificación y el interés en la realización de la FML en vinos blancos y espumosos hacen necesario el estudio del comportamiento de las diferentes especies de BL durante la FML, la búsqueda de nuevas estrategias de inoculación y adaptación de los cultivos iniciadores a estas condiciones de bajo pH. La tabla 2 recoge una descripción general de las estrategias y las especies microbianas utilizadas para desarrollar la FML en estas condiciones de pH.
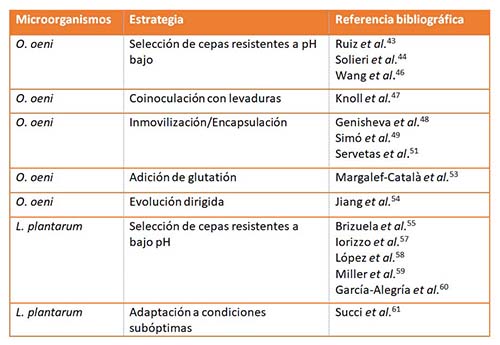
Aunque recientemente las investigaciones buscan cultivos iniciadores alternativos a O. oeni, la mayoría de estudios hasta la fecha se han centrado en el estudio de esta especie por ser la más resistente a pH bajos. Una de las principales estrategias para llevar a cabo la FML en estas condiciones es caracterizar y seleccionar las cepas de O. oeni capaces de crecer y desarrollar la fermentación a pH bajos.43-46 Ruiz et al. realizaron un estudio comparativo utilizando una cepa autóctona (C22L9) y una cepa comercial de O. oeni en cuatro variedades de vino con niveles de pH bajo.43 Los resultados mostraron diferencias importantes tanto en la duración de FML entre vinos como entre cepas. La cepa autóctona presentó mejores propiedades sensoriales que la cepa comercial y por tanto podía usarse en vinos con diferentes características. Solieri et al. caracterizaron la diversidad genética y fenotípica de 135 BL aisladas de vinos italianos y realizaron una selección multifásica de nuevos cultivos iniciadores malolácticos de O. oeni.44 Los autores evaluaron las propiedades tecnológicas de diferentes genotipos de O. oeni en medio sintético con pH bajos (3,5, 3,2 y 3,0) y valores altos de etanol (10, 11 y 13% v/v), proporcionando una estrategia eficiente para seleccionar cepas de O. oeni con rendimientos de actividad maloláctica deseables y capaces de sobrevivir en condiciones que simulan condiciones de estrés en vino.
Estos estudios hacen patente la importancia del proceso de selección del cultivo iniciador para unas condiciones determinadas. Knoll et al. investigaron el impacto de diferentes estrategias de inoculación para llevar a cabo la FML con dos cepas diferentes de O. oeni en vinos de la variedad riesling con una alta acidez (pH 2,9-3,1).47 La estrategia de inoculación simultánea de levadura y bacteria mostró una reducción en el tiempo total de fermentación (FA y FML) en comparación con las inoculaciones secuenciales. En comparación con la inoculación secuencial, los vinos tendían a tener concentraciones más altas de ésteres etílicos y de acetato. Los resultados de este estudio ofrecen algunas alternativas para la realización segura de la FML en mostos blancos de clima frío y bajo pH y con alto contenido de alcohol.
Una segunda estrategia es proteger las células de las consecuencias del estrés causado por el pH bajo mediante la encapsulación o inmovilización de las BL. Genisheva et al. evaluaron la eficiencia de la inmovilización de células de O. oeni en diferentes soportes para la implementación de la FML en vino blanco,48 y Simó et al. valoraron la encapsulación de O. oeni en cápsulas de sílice-alginato.49,50 Estos estudios mostraron la protección de las células inmovilizadas contra los efectos inhibitorios del vino. Resultados positivos se han encontrado también al coinmovilizar S. cerevisiae y O. oeni en celulosa recubierta de almidón para llevar a cabo una FA y FML simultáneas51 o en perlas de alginato.52 La coinmovilización de S. cerevisiae y O. oeni permitió un proceso de fermentación eficiente, produciendo bajos niveles de acidez volátil y concentraciones de etanol y glicerol comparables a las obtenidas en una inoculación secuencial. La estrategia de coinmovilización generó en ambos casos una disminución significativa en el tiempo necesario para completar la FA y la FML. Otra forma de protección de las BL a las condiciones de estrés presentes en el vino es mediante el uso de glutatión para la recuperación del equilibrio rédox celular.53 A pesar de la incapacidad de O. oeni para sintetizar glutatión, esta bacteria puede asimilarlo del medio aumentando los ácidos grasos de ciclopropano en la membrana celular, tanto en la fase exponencial como en la estacionaria, lo que genera una mayor supervivencia de la bacteria en condiciones de estrés.
«Se podría usar la evolución dirigida como una herramienta para generar cultivos iniciadores de FML más eficientes, diseñados para vinos con múltiples factores de estrés como es el pH bajo.»
Con el fin de generar cepas de O. oeni capaces de llevar la FML en condiciones de estrés (alta concentración de etanol, bajo pH), Jiang et al. diseñaron una estrategia de evolución dirigida a partir de un cultivo continuo de esta bacteria.54 Se cultivaron diferentes cepas de O. oeni durante 350 generaciones en un ambiente similar al vino tinto en el que se iban aumentando los niveles de factores de estrés. Los resultados mostraron que tres cepas fueron capaces de finalizar la FML en 160 h, en condiciones de etanol de 15,1% (v/v), 26 mg/L de SO2 a pH 3,35, mientras que la cepa original no fermentó más de dos tercios del ácido L-málico presente en el medio. Estos hallazgos demuestran la posibilidad de usar la evolución dirigida como una herramienta para generar cultivos iniciadores de FML más eficientes, diseñados para vinos con múltiples factores de estrés como es el pH bajo.
Diversos autores proponen como alternativa a O. oeni el uso de cepas de L. plantarum y varios estudios han demostrado la capacidad de L. plantarum para crecer eficientemente a pH bajo.55-60 Por ejemplo, García-Alegría et al. describieron que varias cepas de L. plantarum aisladas de vinos tintos de la DO Rioja pudieron crecer con éxito en medio MLO a pH 3,2 y alcanzar concentraciones celulares similares a los de las cepas de O. oeni.60 Iorizzo et al. llevaron a cabo la caracterización tecnológica de 11 cepas de L. plantarum aisladas de vinos del sur de Italia.57 Estas cepas se caracterizaron según sus propiedades enológicas, su capacidad para producir aminas biógenas y bacteriocinas, su respuesta a la presencia de compuestos fenólicos, sus actividades enzimáticas, etc. Finalmente, se evaluó la actividad maloláctica en la variedad cabernet sauvignon, utilizando dos métodos de inoculación, demostrando que la cepa de L. plantarum seleccionada no producía aminas biógenas, mostraba una buena resistencia al pH bajo y etanol elevado, y tenía buenas actividades maloláctica y beta-glucosidásica. Succi et al. exponen además que la adaptación L. plantarum a condiciones de estrés subóptimas producen una mejora de la tolerancia al mismo estrés pero en condiciones más extremas.61 De hecho, algunas cepas mostraron una mejora en el µmáx cuando se expusieron a condiciones de estrés por ácido (pH 3,5) o etanol (8%) después de una adaptación a largo plazo a pH 5,0 o con 2% de etanol, respectivamente. Por otro lado, investigaciones recientes sugieren el uso de cepas de Pediococcus spp. en la vinificación. No obstante, también resaltan la falta de comprensión de los factores que influyen en el crecimiento y su potencial para causar alteraciones en el vino.16
Conclusiones
Gracias a las continuas investigaciones, actualmente poseemos una mejor comprensión de cómo la FML puede usarse para influir en el estilo del vino que se desea producir. La elección de la cepa de BL y el momento de la inoculación bacteriana son cruciales para poder realizar la FML y sobre todo en vinos con pH extremos. Además, un buen control de esta fermentación permite intervenir y modular las características sensoriales de los vinos.1 Las investigaciones futuras deben centrarse en aumentar el conocimiento de la diversidad microbiana, de las diferentes capacidades de resistencia a condiciones de estrés que tienen las diferentes cepas y las diferencias sensoriales que pueden aportar a través de la metabolómica62,63 y la genómica.64,65
Del mismo modo es interesante el estudio del origen geográfico de las cepas para la selección de cultivos iniciadores malolácticos resistentes a pH extremos.66,67 Además de poder seleccionar cepas adaptadas a las condiciones de un determinado estilo de vino, la inoculación de cepas autóctonas permite poner en valor el concepto de terroir.68 Sin embargo, el aislamiento de cepas potencialmente más adecuadas para el clima de una región en particular y las estrategias y condiciones de inoculación no se han estudiado en profundidad. Siguen haciendo falta nuevas investigaciones para encontrar cepas adecuadas para todas las condiciones y variedades de uva.1
En los últimos años se han buscado estrategias alternativas a la inoculación secuencial de O. oeni tras la FA para llevar a cabo la FML en vinos con condiciones difíciles. El uso de especies como L. plantarum, P. damnosus o S. pombe es un área en creciente desarrollo y existen ya numerosos cultivos iniciadores comerciales.8,15,16,30
Por otro lado es necesario continuar las investigaciones sobre el efecto sinérgico de los diferentes factores de estrés que se encuentran en el vino y por qué algunas cepas se ven más afectadas que otras ante diferentes niveles de pH. Es imprescindible seguir evaluando fisiológica y metabólicamente los mecanismos de tolerancia a la toxicidad en las BL y los cambios de integridad de la membrana plasmática ante el estrés causado por pH bajos.
Por último, es necesario seguir aumentando el conocimiento a nivel genómico y transcriptómico de la especie O. oeni. Todavía no se han desarrollado sistemas de transformación ni es posible modificar la presencia y expresión génica en esta bacteria. La capacidad de ejecutarlo ayudará a delinear rápidamente las rutas metabólicas y sistemas de respuesta al estrés y se podrán desarrollar métodos para mejorar, por ejemplo, la expresión de los genes implicados en la FML ante determinadas condiciones de vinificación.
Bibliografía
1. Sumby KM, Bartle L, Grbin PR, Jiranek V. 2019. Measures to improve wine malolactic fermentation. Applied Microbiology and Biotechnology 103:2033-2051.
2. Cinquanta L, De Stefano G, Formato D, Niro S, Panfili G. 2018. Effect of pH on malolactic fermentation in southern Italian wines. European Food Research and Technology 244:1261-1268.
3. Guzzon R, Poznanski E, Conterno L, Vagnoli P, Krieger-Weber S, Cavazza A. 2009. Selection of a new highly resistant strain for malolactic fermentation under difficult conditions. South African Journal of Enology and Viticulture 30:133-141.
4. Liu J, Arneborg N, Toldam-Andersen TB, Zhang S, Petersen MA, Bredie WLP. 2017. Impact of sequential co-culture fermentations on flavour characters of Solaris wines. European Food Research and Technology 243:437-445.
5. Bonomo MG, Di Tomaso K, Calabrone L, Salzano G. 2018. Ethanol stress in Oenococcus oeni: transcriptional response and complex physiological mechanisms. Journal of Applied Microbiology:n/a-n/a.
6. Mira de Orduña R. 2010. Climate change associated effects on grape and wine quality and production. Food Research International 43:1844-1855.
7. Pardo I, Ferrer S. 2019. Chapter 7 – Yeast-Bacteria Coinoculation, p. 99-114. In Morata A (ed.), Red Wine Technology. Academic Press.
8. Lucio O, Pardo I, Heras JM, Krieger S, Ferrer S. 2018. Influence of yeast strains on managing wine acidity using Lactobacillus plantarum. Food Control 92:471-478.
9. Lucio O, Pardo I, Heras JM, Krieger-Weber S, Ferrer S. 2017. Use of starter cultures of Lactobacillus to induce malolactic fermentation in wine. Australian Journal of Grape and Wine Research 23:15-21.
10. Lucio O, Pardo I, Krieger-Weber S, Heras JM, Ferrer S. 2016. Selection of Lactobacillus strains to induce biological acidification in low acidity wines. LWT – Food Science and Technology 73:334-341.
11. Berbegal C. 2014. Novel liquid starter cultures for malolactic fermentation in wine. Ph D Thesis, University of Valencia (Spain).
12. Berbegal C, Fragasso M, Russo P, Bimbo F, Grieco F, Spano G, Capozzi V. 2019. Climate changes and food quality: the potential of microbial activities as mitigating strategies in the wine sector. Fermentation 5:85.
13. Benavent-Gil Y, Berbegal C, Lucio O, Pardo I, Ferrer S. 2016. A new fear in wine: Isolation of Staphylococcus epidermidis histamine producer. Food Control 62:142-149.
14. Henick-Kling T. 1993. Malolactic fermentation, p. 289-326. In Fleet GH (ed.), Wine microbiology and biotechnology. Harwood Academic Publishers, Chur, Switzerland.
15. Berbegal C, Peña N, Russo P, Grieco F, Pardo I, Ferrer S, Spano G, Capozzi V. 2016. Technological properties of Lactobacillus plantarum strains isolated from grape must fermentation. Food Microbiology 57:187-194.
16. Wade ME, Strickland MT, Osborne JP, Edwards CG. 2019. Role of Pediococcus in winemaking. Australian Journal of Grape and Wine Research 25:7-24.
17. du Toit M, Engelbrecht L, Lerm E, Krieger-Weber S. 2011. Lactobacillus: the next generation of malolactic fermentation starter cultures—an overview. Food and Bioprocess Technology 4:876-906.
18. Liu S-Q. 2002. Malolactic fermentation in wine – beyond deacidification. Journal of Applied Microbiology 92:589-601.
19. Matthews A, Grimaldi A, Walker M, Bartowsky E, Grbin P, Jiranek V. 2004. Lactic Acid Bacteria as a potential source of enzymes for use in vinification. Applied and Environmental Microbiology 70:5715-5731.
20. Lerm E, Engelbrecht L, du Toit M. 2011. Selection and characterisation of Oenococcus oeni and Lactobacillus plantarum South African wine isolates for use as malolactic fermentation starter cultures. South African Journal of Enology and Viticulture 32:280-295.
21. Onetto C, Bordeu E. 2015. Pre-alcoholic fermentation acidification of red grape must using Lactobacillus plantarum. Antonie van Leeuwenhoek 108:1469-1475.
22. Bravo-Ferrada BM, Hollmann A, Delfederico L, Valdés La Hens D, Caballero A, Semorile L. 2013. Patagonian red wines: selection of Lactobacillus plantarum isolates as potential starter cultures for malolactic fermentation. World Journal of Microbiology and Biotechnology 29:1537-1549.
23. Guerzoni ME, Sinigaglia M, Gardini F, Ferruzzi M, Torriani S. 1995. Effects of pH, temperature, ethanol, and malate concentration on Lactobacillus plantarum and Leuconostoc oenos: modelling of the malolactic activity. American Journal of Enology and Viticulture 46:368-374.
24. Lerm E, Engelbrecht L, du Toit M. 2010. Malolactic termentation: the ABC’s of MLF. South African Journal of Enology and Viticulture 31:186-212.
25. De Vos P, Garrity, G., Jones, D., Krieg, N.R., Ludwig, W., Rainey, F.A., Schleifer, K-H. and Whitman, W.B. 2011. Bergey’s manual of systematic bacteriology: the Firmicutes, Second ed, vol. Three. Springer Dordrecht Heidelberg London, New York.
26. Lucio O. 2014. Acidificación biológica de vinos de pH elevado mediante la utilización de bacterias lácticas. Ph. D. Thesis. Universidad de Valencia.
27. Lucio O, Pardo I, Heras JM, Krieger S, Ferrer S. 2014. Effect of yeasts/bacteria co-inoculation on malolactic fermentation of Tempranillo wines, Infowine, http://www.infowine.com/default.asp?scheda=13630.
28. Pilatte E, Prahl C. 1997. Biological deacidification of acide grape varieties by inoculation on must with a freeze-dried culture of Lactobacillus plantarum. Annual Meeting ASEV, San Diego, California (Ed.) J. Rautz, 1-2 de Julio 1997.
29. Benito A, Jeffares D, Palomero F, Calderon F, Bai FY, Bahler J, Benito S. 2016. Selected Schizosaccharomyces pombe strains have characteristics that are beneficial for winemaking. PLoS One 11:e0151102.
30. Loira I, Morata A, Palomero F, González C, Suárez-Lepe JA. 2018. Schizosaccharomyces pombe: a promising biotechnology for modulating wine composition. Fermentation 4:70.
31. Husnik JI, Volschenk H, Bauer J, Colavizza D, Luo Z, van Vuuren HJJ. 2006. Metabolic engineering of malolactic wine yeast. Metabolic Engineering 8:315-323.
32. Minnaar P. 2017. Saccharomyces cerevisiae, non-Saccharomyces yeasts and lactic acid bacteria in sequential fermentations: Effect on phenolics and sensory attributes of South African Syrah wines, vol. 38.
33. Mylona AE, Del Fresno JM, Palomero F, Loira I, Bañuelos MA, Morata A, Calderón F, Benito S, Suárez-Lepe JA. 2016. Use of Schizosaccharomyces strains for wine fermentation—Effect on the wine composition and food safety. International Journal of Food Microbiology 232:63-72.
34. Benito S, Palomero F, Calderón F, Palmero D, Suárez-Lepe JA. 2014. Schizosaccharomyces A2 – Batt, Carl A, p. 365-370. In Tortorello ML (ed.), Encyclopedia of Food Microbiology (Second Edition). Academic Press, Oxford.
35. Benito S, Palomero F, Morata A, Calderón F, Suárez-Lepe JA. 2012. New applications for Schizosaccharomyces pombe in the alcoholic fermentation of red wines. International Journal of Food Science & Technology 47:2101-2108.
36. Russo P, Capozzi V, Spano G, Corbo MR, Sinigaglia M, Bevilacqua A. 2016. Metabolites of microbial origin with an impact on health: ochratoxin A and biogenic amines. Frontiers in Microbiology 7:482.
37. Izquierdo Cañas PM, Pérez-Martín, F., García Romero, E., Seseña Prieto, S. and Palop Herreros, M. LL. 2012. Influence of inoculation time of an autochthonous selected malolactic bacterium on volatile and sensory profile of Tempranillo and Merlot wines. International Journal of Food Microbiology 156:245-254.
38. Tristezza M, di Feo L, Tufariello M, Grieco F, Capozzi V, Spano G, Mita G, Grieco F. 2016. Simultaneous inoculation of yeasts and lactic acid bacteria: Effects on fermentation dynamics and chemical composition of Negroamaro wine. LWT – Food Science and Technology 66:406-412.
39. Ruiz P, Izquierdo PM, Seseña S, Palop ML. 2010. Selection of autochthonous Oenococcus oeni strains according to their oenological properties and vinification results. International Journal of Food Microbiology 137:230-235.
40. Berbegal C, Garofalo C, Russo P, Pati S, Capozzi V, Spano G. 2017. Use of autochthonous yeasts and bacteria in order to control Brettanomyces bruxellensis in wine. Fermentation 3:65.
41. Bauer R, Volschenk H, Dicks LMT. 2005. Cloning and expression of the malolactic gene of Pediococcus damnosus NCFB1832 in Saccharomyces cerevisiae. Journal of Biotechnology In Press, Corrected Proof.
42. Lerena MC, Rojo MC, Sari S, Mercado LA, Krieger-Weber S, Combina M. 2016. Malolactic fermentation induced by Lactobacillus plantarum in Malbec wines from Argentina. South African Journal of Enology and Viticulture 37:115-123.
43. Ruiz P, Izquierdo PM, Seseña S, García E, Palop ML. 2012. Malolactic fermentation and secondary metabolite production by Oenoccocus oeni strains in low pH wines. Journal of Food Science 77:M579-M585.
44. Solieri L, Genova F, De Paola M, Giudici P. 2010. Characterization and technological properties of Oenococcus oeni strains from wine spontaneous malolactic fermentations: a framework for selection of new starter cultures. Journal of Applied Microbiology 108:285-298.
45. Romero J, Ilabaca C, Ruiz M, Jara C. 2018. Oenococcus oeni in Chilean red wines: technological and genomic characterization. Frontiers in Microbiology 9.
46. Wang P, Li A, Sun H, Dong M, Wei X, Fan M. 2016. Selection and characterization of Oenococcus oeni strains for use as new malolactic fermentation starter cultures. Annals of Microbiology:1-8.
47. Knoll C, Fritsch S, Schnell S, Grossmann M, Krieger-Weber S, du Toit M, Rauhut D. 2012. Impact of different malolactic fermentation inoculation scenarios on Riesling wine aroma. World Journal of Microbiology and Biotechnology 28:1143-1153.
48. Genisheva Z, Mussatto SI, Oliveira JM, Teixeira JA. 2013. Malolactic fermentation of wines with immobilised lactic acid bacteria – Influence of concentration, type of support material and storage conditions. Food Chemistry 138:1510-1514.
49. Simó G, Fernández-Fernández E, Vila-Crespo J, Ruipérez V, Rodríguez-Nogales JM. 2017. Silica–alginate-encapsulated bacteria to enhance malolactic fermentation performance in a stressful environment. Australian Journal of Grape and Wine Research 23:342-349.
50. Simó G, Fernández-Fernández E, Vila-Crespo J, Ruipérez V, Rodríguez-Nogales JM. 2019. Effect of stressful malolactic fermentation conditions on the operational and chemical stability of silica-alginate encapsulated Oenococcus oeni. Food Chemistry 276:643-651.
51. Servetas I, Berbegal C, Camacho N, Bekatorou A, Ferrer S, Nigam P, Drouza C, Koutinas AA. 2013. Saccharomyces cerevisiae and Oenococcus oeni immobilized in different layers of a cellulose/starch gel composite for simultaneous alcoholic and malolactic wine fermentations. Process Biochemistry 48:1279-1284.
52. Bleve G, Tufariello M, Vetrano C, Mita G, Grieco F. 2016. Simultaneous alcoholic and malolactic fermentations by Saccharomyces cerevisiae and Oenococcus oeni cells co-immobilized in alginate beads. Frontiers in Microbiology 7:943.
53. Margalef-Català M, Araque I, Weidmann S, Guzzo J, Bordons A, Reguant C. 2017. Protective role of glutathione addition against wine-related stress in Oenococcus oeni. Food Research International.
54. Jiang J, Sumby KM, Sundstrom JF, Grbin PR, Jiranek V. 2018. Directed evolution of Oenococcus oeni strains for more efficient malolactic fermentation in a multi-stressor wine environment. Food Microbiology 73:150-159.
55. Brizuela N, Tymczyszyn EE, Semorile LC, La Hens DV, Delfederico L, Hollmann A, Bravo-Ferrada B. 2018. Lactobacillus plantarum as a malolactic starter culture in winemaking: A new (old) player? Electronic Journal of Biotechnology.
56. Brizuela NS, Bravo-Ferrada BM, Curilén Y, Delfederico L, Caballero A, Semorile L, Pozo-Bayón MÁ, Tymczyszyn EE. 2018. Advantages of using blend cultures of native L. plantarum and O. oeni strains to induce malolactic fermentation of Patagonian Malbec wine. Frontiers in Microbiology 9:2109.
57. Iorizzo M, Testa B, Lombardi SJ, García-Ruiz A, Muñoz-González C, Bartolomé B, Moreno-Arribas MV. 2016. Selection and technological potential of Lactobacillus plantarum bacteria suitable for wine malolactic fermentation and grape aroma release. LWT – Food Science and Technology 73:557-566.
58. López I, López R, Santamaría P, Torres C, Ruiz-Larrea F. 2008. Performance of malolactic fermentation by inoculation of selected Lactobacillus plantarum and Oenococcus oeni strains isolated from Rioja red wines. Vitis 47:123-129.
59. Miller BJ, Franz CMaP, Cho G-S, du Toit M. 2011. Expression of the malolactic enzyme gene (mle) from Lactobacillus plantarum under winemaking conditions. Current microbiology 62:1682-1688.
60. García-Alegría E, López I, Ruiz JI, Sáenz J, Fernández E, Zarazaga M, Dizy M, Torres C, Ruíz-Larrea F. 2004. High tolerance of wild Lactobacillus plantarum and Oenococcus oeni strains to lyophilisation and stress environmental conditions of acid pH and ethanol. FEMS Microbiology Letters 230:53-61.
61. Succi M, Pannella G, Tremonte P, Tipaldi L, Coppola R, Iorizzo M, Lombardi SJ, Sorrentino E. 2017. Sub-optimal pH preadaptation improves the survival of Lactobacillus plantarum strains and the malic acid consumption in wine-like medium. Frontiers in Microbiology 8.
62. Bokulich NA, Collins TS, Masarweh C, Allen G, Heymann H, Ebeler SE, Mills DA. 2016. Associations among wine grape microbiome, metabolome, and fermentation behavior suggest microbial contribution to regional wine characteristics. mBio 7.
63. Lee J-E, Hwang G-S, Lee C-H, Hong Y-S. 2009. Metabolomics Reveals Alterations in Both Primary and Secondary Metabolites by Wine Bacteria. Journal of Agricultural and Food Chemistry 57:10772-10783.
64. Bartowsky EJ, Borneman AR. 2011. Genomic variations of Oenococcus oeni strains and the potential to impact on malolactic fermentation and aroma compounds in wine. Applied Microbiology and Biotechnology 92:441-447.
65. Sternes PR, Costello PJ, Chambers PJ, Bartowsky EJ, Borneman AR. 2017. Whole transcriptome RNAseq analysis of Oenococcus oeni reveals distinct intra-specific expression patterns during malolactic fermentation, including genes involved in diacetyl metabolism. International Journal of Food Microbiology 257:216-224.
66. Campbell-Sills H, El Khoury M, Gammacurta M, Miot-Sertier C, Dutilh L, Vestner J, Capozzi V, Sherman D, Hubert C, Claisse O, Spano G, de Revel G, Lucas P. 2017. Two different Oenococcus oeni lineages are associated to either red or white wines in Burgundy: genomics and metabolomics insights. 2017 51.
67. El Khoury M, Campbell-Sills H, Salin F, Guichoux E, Claisse O, Lucas PM. 2017. Biogeography of Oenococcus oeni reveals distinctive but non-specific populations in wine-producing regions. Applied and Environmental Microbiology. 68. Capozzi V, Garofalo C, Chiriatti MA, Grieco F, Spano G. 2015. Microbial terroir and food innovation: The case of yeast biodiversity in wine. Microbiological Research 181:75-83.






