La fermentación del mosto en vino es una reacción microbiológica compleja en la que se produce un desarrollo secuencial de levaduras y bacterias lácticas.1-4 Tradicionalmente, el vino se produce por la fermentación natural llevada a cabo por las levaduras. El origen de estas levaduras puede ser la superficie de las uvas o el ambiente de la bodega (maquinaria, fermentadores, etc.). La dinámica de la flora responsable del proceso fermentativo del mosto ha sido objeto de numerosos estudios.
La microflora presente en la superficie de la uva se ve afectada por un gran número de factores que influyen en la proporción de las diferentes especies. Entre estos factores se incluyen la temperatura, la pluviosidad y otras influencias climáticas,5,5a,6 el grado de madurez de la cosecha,7,8 el uso de funguicidas,9 el daño físico debido a hongos, insectos, etc.6 y la variedad de uva. Por otro lado, cuando la superficie de la maquinaria de la bodega, como prensas, tanques, fermentadores y bombas, entre otros elementos, entra en contacto con el mosto de uva constituye otra fuente de aporte de levaduras. Esta flora residente en el ambiente de la bodega está formada mayoritariamente por S. cerevisiae,10,11 aunque también se han aislado especies de los géneros Candida, Pichia, Hansenula y Brettanomyces. Sin embargo, la especie Saccharomyces cerevisiae es la responsable de la fermentación alcohólica a pesar de que sus niveles en la uva son bajos, alrededor de 50 células/mL,11 durante la fermentación se multiplica rápidamente y desplaza a otros microorganismos que eventualmente invaden el mosto. No obstante, variaciones en la flora inicial pueden influir en la calidad del vino y dar lugar a cambios en la acidez volátil y a sabores y olores desagradables.12
Utilización de levaduras seleccionadas en vinificación
Desde un punto de vista microbiológico, la variabilidad en la flora levaduriforme de los mostos puede solventarse adicionando en cada campaña de vendimia un inóculo microbiano que, al ser mayoritario, normalice la flora inicial y, de esta forma, dé lugar a una fermentación homogénea año tras año. Aunque cultivos líquidos de levadura vínica han sido utilizados desde 1930 (Instituto Laclaire, Francia), las levaduras vínicas secas no se originaron hasta mediados de los años cincuenta, cuando de forma independiente varios laboratorios europeos, canadienses y estadounidenses llevaron a cabo una selección de levaduras vínicas que posteriormente utilizaron como inóculo en fermentaciones dirigidas.11 Todos ellos concluyeron que las levaduras vínicas seleccionadas crecían bien en una fermentación de mosto y que producían un buen vino. Desde entonces, en varias zonas de Europa, Estados Unidos, Canadá y Australia se realizan fermentaciones utilizando cultivos iniciadores.13 Hoy se comercializan más de cien cepas diferentes pertenecientes principalmente a seis casas comerciales.
Aunque pueden producirse diferencias en la diversidad microbiana del mosto inicial, ya no sólo entre regiones vitivinícolas distintas, sino también dentro de la misma bodega en diferentes vendimias, la utilización de levaduras seleccionadas produce fermentaciones controladas y, como consecuencia de esta práctica, el vino mantiene sus características sensoriales típicas en cada región.14 Según Cuinier,15 la utilización de levaduras seleccionadas puede evitar alteraciones químicas y microbiológicas en las primeras fases de la fermentación. Por otra parte, también puede evitar anomalías de la fermentación, como paradas espontáneas, o mejorar la composición química e influir en la calidad, tanto gustativa como aromática del vino. Por esta razón, en los últimos años, se ha extendido el uso de levaduras autóctonas de cada región.16
Los estudios de identificación y caracterización de las diferentes especies de levaduras, así como de las cepas que pertenecen a una misma especie han estado basados en criterios morfológicos y fisiológicos.17,18 Estas características pueden variar en función de las condiciones de cultivo y, en ocasiones, las especies han sido delimitadas por una única característica fisiológica, que en algunos casos estaba controlada por un solo gen. Más recientemente se han desarrollado técnicas de biología molecular que se presentan como una alternativa a los métodos tradicionales para la caracterización e identificación de levaduras. Esteve-Zarzoso et al.19 han llevado a cabo una revisión de las técnicas que se aplican en la identificación y caracterización de levaduras.
Por otra parte, también resulta interesante la caracterización de cepas de levaduras con dos fines: en primer lugar, para controlar el proceso de elaboración de levaduras secas activas y, en segundo, para comprobar la implantación de las levaduras comerciales durante la fermentación alcohólica en la bodega. Se han desarrollado diversas técnicas moleculares para la caracterización de cepas vínicas.12,20 Querol et al.21 han desarrollado un método de análisis del DNA mitocondrial (mtDNA) que evita la utilización de gradientes en cloruro de cesio y el uso de una ultracentrífuga, factor limitante para su utilización en la industria. Esta técnica rápida permite el análisis de un mayor número de cepas en menos tiempo, y su aplicación resulta ideal en la industria por su rapidez, seguridad y economía, y por no requerir material sofisticado ni personal muy especializado. Mediante esta técnica Querol et al.22 han mostrado la implantación y el papel de una levadura seca activa (LSA) que había sido inoculada en las fermentaciones de dos bodegas distintas. Se demostró que la cepa inoculada competía con las cepas naturales pero no suprimía completamente su crecimiento hasta varios días después de haber sido inoculada. Sin embargo, el predominio de la cepa inoculada era evidente en ambas bodegas y representó el 68,09 % y el 89,46 % de las colonias aisladas en la fase final de la fermentación.
El uso de levaduras inoculadas y la demostración formal mediante técnicas moleculares de su imposición, junto con los avances en biotecnología, abren la puerta a la modificación genética de las levaduras vínicas.
Mejora genética de levaduras vínicas
Las características genéticas de una levadura vínica pueden ser modificadas según las necesidades de la industria vitivinícola. Se han desarrollado diversas levaduras utilizando técnicas clásicas como la inducción y selección de mutantes, y la hibridación y fusión de protoplastos.23 Sin embargo, la aplicación de las técnicas de DNA recombinante se presenta como un enfoque más sencillo y preciso, tal como veremos a continuación.
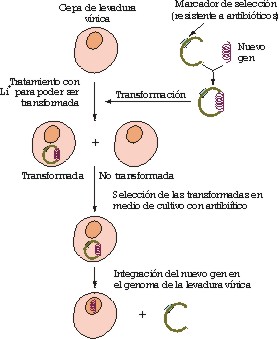
Los pasos básicos para clonar un gen y transformar una levadura vínica (figura 1) son: a) identificación del gen que le va a conferir una característica nueva a la levadura y aislamiento del fragmento de DNA foráneo; b) identificación y linearización mediante el uso de enzimas de restricción del vector (plásmido) que va a servir para introducir el nuevo gen en la levadura (dicho plásmido posee sistemas de selección para las levaduras transformadas o modificadas genéticamente); c) transformación de la levadura, es decir, introducción del vector con el gen en el interior celular; d) selección de las levaduras transformadas, aquellas que han incorporado el plásmido con el nuevo gen; estos sistemas están basados mayoritariamente en resistencias a antibióticos. Estos plásmidos pueden permanecer de forma independiente en la célula o pueden ser «integrativos», o sea que el nuevo gen se integra en una zona concreta del genoma de la levadura eliminando el DNA no necesario del vector y los genes responsables de las resistencias a antibióticos.
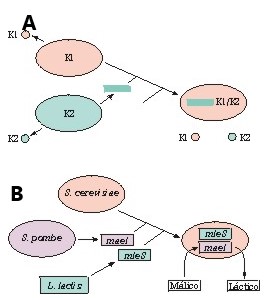
Siguiendo esta metodología es posible construir cepas que expresen actividades metabólicas de interés o que ejerzan efectos beneficiosos en las características organolépticas de los vinos.12,23 Se han desarrollado diversas levaduras vínicas recombinantes. En la figura 2 se muestra la estrategia utilizada para obtener alguna de estas levaduras. Por ejemplo, se han diseñado levaduras vínicas que, al contener los genes que codifican los factores killer K1 y K2, presentan una ventaja ecológica evidente, ya que las levaduras vínicas naturales sólo expresan el factor K1 y, por tanto, son resistentes únicamente a este factor killer. También se ha descrito la construcción de cepas de laboratorio de Saccharomyces cerevisiae que, al expresar el gen de la L(+)-lactato deshidrogenasa de Lactobacillus casei, pueden llevar a cabo una fermentación mixta (lactoalcohólica) y por ello solventar el problema de baja acidez de los vinos de regiones cálidas. Aparte de la fermentación alcohólica, la fermentación maloláctica es un proceso tecnológico de gran importancia en enología. Mediante su uso se logra desacidificar los vinos tintos y algunos vinos blancos en regiones frías. Esta fermentación la llevan a cabo bacterias ácido lácticas, sobre todo Oenococcus oenii, y rebaja la acidez de los vinos al descarboxilar el ácido L-málico a ácido L-láctico. La reacción está catalizada por el llamado enzima málico que ha sido purificado de varias bacterias ácido lácticas. Los genes correspondientes han sido clonados a partir de aislados de Lactobacillus delbrueckii, Lactococcus lactis y Oenococcus oenii. Las cepas de S. cerevisiae no pueden metabolizar el malato del mosto, por lo que la idea de expresar el gen que codifica el enzima málico en la levadura vínica ha sido un objetivo prioritario de la biotecnología enológica. De hecho, durante los últimos años varios grupos han informado sobre la construcción de levaduras vínicas que, si bien expresaban eficazmente genes bacterianos que codifican el enzima málico, no daban lugar a la desacidificación. Recientemente se ha conseguido una vía eficaz de degradación de málico en S. cerevisiae. Para ello se ha construido una levadura recombinante que porta un gen de la levadura Schizosaccharomyces pombe, que codifica una malato permeasa y el gen de L. lactis que codifica el enzima málico. Esta levadura es capaz de fermentar 4,5 g/L de malato en mostos artificiales en tan sólo cuatro días.
Otro ejemplo interesante del uso de las técnicas de ingeniería genética en enología lo constituye la construcción de levaduras vínicas recombinantes que expresan genes que codifican celulasas y hemicelulasas. Es una práctica habitual en las bodegas la adición de estos enzimas para solventar problemas de filtración o incrementar aromas afrutados, pero la heterogeneidad de las preparaciones comerciales (una mezcla de enzimas que varía según el lote) ha hecho de su uso algo impredecible. En nuestro laboratorio se han construido diversas levaduras vínicas recombinantes que contienen genes de hongos filamentosos que codifican beta-(1,4)-endoglucanasa, alfa-L-arabinofuranosidasa, beta-glucosidasa, endoxilanasas y alfa-ramnosidasas. Todas estas levaduras son capaces de secretar los enzimas correspondientes al mosto en cantidades suficientes para llevar a cabo el proceso tecnológico y producir vino con adecuadas características organolépticas. También se ha desarrollado una levadura recombinante que contiene un gen fúngico que codifica una pectato liasa útil para solventar problemas de filtración. Todas estas cepas se pueden usar como herramientas para investigar el papel individual de cada enzima en el proceso de vinificación. En la actualidad estamos investigando sobre el papel de los enzimas puros y la combinación de enzimas más adecuada, dependiendo de las variedades de uva. Otra de las líneas de investigación del grupo, recientemente iniciada, consiste en aumentar la producción de los aromas secundarios mediante el incremento de la capacidad de síntesis de ésteres por parte de la levadura durante la fermentación alcohólica.
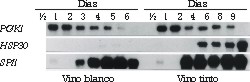
La modificación genética de las levaduras vínicas exige conocer promotores de genes de levaduras que se expresen específicamente durante determinados tiempos de fermentación. Estos promotores se pueden comparar con los interruptores de la luz que encienden o apagan, es decir, que permiten que el gen codifique o no lo haga para la proteína de interés. Por ello, diversos trabajos de investigación tienen como objetivo entender la regulación de la expresión génica en S. cerevisiae durante la vinificación. En la actualidad se dispone de varios promotores que se inducen específicamente durante la prefermentación, fermentación tumultuosa o posfermentación.24 Por otra parte, estos estudios nos han permitido constatar que a nivel de expresión génica, las levaduras se comportan de forma muy distinta en condiciones de laboratorio o en vinificación, incluso se pueden observar diferencias según la variedad de mosto que se va a fermentar (figura 3).
Por último, merece mención especial el reciente desarrollo de protocolos de transformación para las levaduras vínicas que rinden levaduras recombinantes GRAS (de Generally Recognized As Safe) mediante sistemas de integración en el genoma de las levaduras evitando el uso de resistencias a antibióticos, uno de los mayores problemas en el uso de microorganismos modificados genéticamente.25
Bibliografía
1. Amerine M.A., Kunkee R.E.: «Microbiology of winemaking», Ann Rev Microbiol 1968; 22: 323-358.
2. Kunkee R.E., Goswell r.W.: «Table Wines». En: Rose A.H., Harrison J.S., eds., Alcoholic Beberages. Economic Microbiology. Vol. 1. Londres, Academic Press, 1977: 315-385.
3. Margalith P.Z.: Flavor Microbiology, Springfield, Charles C. Thomas Publisher, 1981.
4. Benda I.: «Wine and brandy», En: Reed G.: Prescott and Dunn´s industrial microbiology, Westport, Conn., AVI Technical Books, 1982: 293-402.
5. Querol A., Jiménez m., huerta t.: «Microbiological and enological parameters during fermentation of musts from poor and normal grape-harvest in the region of Alicante (Spain)», J Food Sci 1990; 55: 1603-1606.
5a. Querol A., Barrio E.: «A rapid and simple method for the preparation of yeast mitochondrial DNA», Nucl Acids Res 1990; 18: 1657.
6. Longo E., Cansado j., agrelo d., Villa t.: «Effect of climatic conditions on yeast diversity in grape musts from northwest Spain», Am J Enol Vitic 1991; 42: 141-144.
7. Rosini, G., federichi f., martini a.: «Yeast flora of grape berries during ripening», Microb Ecol 1982; 8: 83-89.
8. Martínez j., millán C., ortega j.m.: «Growth of natural flora during the fermentation of inoculated musts from ‘Pedro Ximenez’ grapes», S Afr J Enol Vitic 1989; 10: 31-35.
9. Bureau G., brun o., vigues a., maujean a., vesselle g., feuillat a.: «Etude d´une microflore levurienne champenoise», Connaiss Vigne Vin 1982; 16: 15-32.
10. Martini A., vaughan-martini a.: «Grape must fermentation: Past and Present», En: Spencer J.F.T., Spencer D.M.: Yeast technology, Berlín, Springer-Verlag, 1990: 105-123.
11. Fleet G., Heard G.: «Yeast growth during fermentation», En: Fleet G.: Wine microbiology and biotechnology, Berna, Harwood Academic Publishers, 1993: 27-57.
12. Querol A., Ramón D.: (1996). «The application of molecular techniques in wine microbiology», Trends Food Sci Technol 1996; 7 (3): 73-78.
13. Reed G.y., Nagodawithana w.: «Technology of yeast usage in wine making. Am J Enol Vitic 1988; 39: 83-90.
14. Lafon-Lafourcade S.: «Wine and brandy», En: Reed G.: Biotechnology, Vol. 5, Heidelberg, Verlag-Chemie, 1983: 81-163.
15. Cuinier C.: «Le levurage spécifique», Viticulture Tourangelle 1986; 215: 15-18.
16. Snow R.: «Genetic improvement of wine yeast», En: Spencer J.F.T., Spencer D.M., Smith A.R.W.: Yeast Genetics. Fundamental and Applied Aspects, Berlín, Springer Verlag, 1975: 439-458.
17. Kreger-van Rij N.J.W.: The yeast, a taxonomic study, Amsterdam, Elsevier Science Publisher B.V., 1984,
18. Barnett J.A., Payne R.W., Yarrow W.I.J.: Yeast: Characterization and identification, 2ª ed., Londres, Cambridge University Press, 1990.
19. Esteve-Zarzoso B., Manzanares P., Ramón D., Querol A.: «The role of non-Shaccharomyces yeast in industrial winemaking», Int Microbiol 1998; 1: 143-148.
20. Loureiro V., Querol A.: «The prelevance and control of spoilage yeasts in foods and beverages», Trends Food Sci Technol 1999; 10: 356-365.
21. Querol A., Barrio E., Ramón D.: «A comparative study of different methods of yeast strain characterization», Sys. Appl Microbiol 1992; 15: 439-446.
22. Querol A., Barrio E., Huerta T., Ramón D.: «Molecular monitoring of wine fermentations conducted by active dry yeast strains», Appl Environ Microbiol 1992; 58: 2948-2953.
23. Pretorius I.S.: «Tailoring wine yeast for the new millennium: novel approaches to the ancient art of winemaking», Yeast 2000; 16: 675-729.
24. Puig S., Ramón D., Pérez-Ortín J.E.: «Optimised method to obtain stable food-safe recombinant wine yeast strains», J Agr Food Chem 1998; 46: 1689-1693.
24a. Puig S., Querol A., Ramón D., Pérez-Ortín J.E.: «Evaluation of the use of phase-specific gene promoters for the expression of enological enzymes in an industrial wine yeast strain», Biotechnol Lett 1996; 18: 887-892.