Los azúcares son la principal fuente de carbono y energía para las bacterias lácticas y éstos son catabolizados por vía fermentativa. En el mosto de uva se encuentran principalmente glucosa y fructosa en cantidades similares. La concentración de ambos azúcares en el jugo de uva madura es de 150 a 250 g/L. También se hallan varias pentosas (L-arabinosa, D-xilosa D-ribosa y L-rhamnosa) en cantidades de 0,3 a 2 g/L, y varios disacáridos, tales como melibiosa, maltosa, lactosa, rafinosa y sacarosa, también en baja concentración (Cabanis et al., 2000, y Ribéreau-Gayon et al., 2000b).
Las bacterias lácticas pueden exhibir dos tipos de metabolismo respecto a las hexosas: homofermentativo y heterofermentativo. El metabolismo homofermentativo se caracteriza porque las hexosas son fermentadas vía Embden-Meyerhof, dando lugar, exclusivamente, a dos moles de ácido láctico por cada mol de hexosa metabolizada. El metabolismo heterofermentativo se lleva a cabo mediante la vía del 6-fosfogluconato y origina por cada mol de hexosa consumida, 1 mol de CO2, 1 mol de etanol (o ácido acético) y 1 mol de ácido láctico (fig. 1). Las bacterias lácticas que sólo poseen esta vía para fermentar los azúcares se denominan heterofermentativas estrictas (Thompson y Gentry-Weeks, 1994).
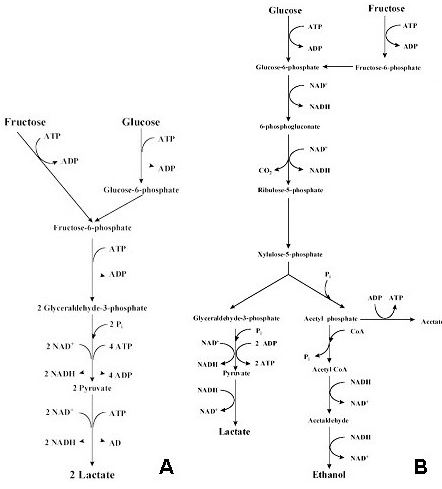
A) Vía homofermentativa o de Embden-Meyerhoff
B) Vía heterofermentativa o de la fosfocetolasa
En ambas vías metabólicas, el piruvato es un intermediario común y puede tener varios destinos, como la síntesis de compuestos aromáticos (diacetilo o acetoína) o la de ácido acético. En condiciones de limitación de hexosas, la síntesis de ácido acético puede llegar a ser dominante, de forma que un microorganismo homofermentativo puede mostrarse como heterofermentativo produciendo ácido acético, etanol y ácido fórmico como productos finales del metabolismo (Thomas et al., 1979 y de Vries et al., 1970).
Desde el punto de vista enzimático también existen diferencias entre las bacterias lácticas homofermentativas y los heterofermentativas. Así, las primeras se caracterizan por poseer una FDP aldolasa (ausente en las heterofermentativas), mientras que las segundas poseen una fosfocetolasa que no existe en las homofermentativas. La ausencia de fosfocetolasa en las homofermentativas les incapacita para fermentar las pentosas. Sin embargo, un grupo de lactobacilos posee una fosfocetolasa inducible por pentosas. Esta fosfocetolasa les permite transformar las pentosas en ácido láctico y etanol/ácido acético, mientras que las hexosas producen únicamente ácido láctico por vía homoláctica. Este grupo de lactobacilos tiene un metabolismo heterofermentativo facultativo (Ribéreau-Gayon et al., 2000a).
Las pentosas se fermentan de manera similar en las bacterias lácticas heterofermentativas facultativas o estrictas y siempre dan lugar a ácido acético y a ácido láctico. En el caso de las heterofermentativas estrictas, las hexosas también podrían dar lugar a ácido acético; sin embargo, existen mecanismos regulatorios que hacen que esto sea infrecuente (Ribéreau-Gayon et al., 2000a).
Las bacterias lácticas del vino también pueden producir polisacáridos extracelulares que pueden ser de distinta naturaleza química: dextrano, levanos, glucanos o heteropolisacáridos. La presencia de estos polisacáridos en el vino hace que éste se vuelva más viscoso. Las especies responsables de la formación de estos compuestos son Pediococcus damnomus, Leuconostoc mesenteroides y Lactobacillus brevis, aunque hay que tener en cuenta que la capacidad para sintetizar polisacáridos es dependiente de cepa (Ribéreau-Gayon et al., 2000a).
Los principales ácidos orgánicos presentes en los mostos son: ácido tartárico (2-6 g/L), ácido málico (1-6,5 g/L), ácido cítrico (0,1-1 g/L); también se encuentran los ácidos ascórbico y glucónico aunque en cantidades menores que los anteriores (Cabanis et al. 2000). Como consecuencia de la actividad microbiana durante la fermentación, otros ácidos como el pirúvico, L o D-láctico, succínico, acético, citramálico, oxalacético y fumárico pueden aparecer. Las bacterias lácticas degradan mayoritariamente el ácido málico y el ácido cítrico y, con mucha menor frecuencia, el ácido tartárico. La capacidad para degradar los dos primeros ácidos está muy extendida entre las especies que proliferan tras la fermentación alcohólica y esta degradación provoca numerosos e importantes cambios organolépticos en el vino.
Las vía metabólica por la que el ácido málico es degradado por las bacterias lácticas del vino es aquella que implica la actuación del enzima maloláctico. Este enzima se aisló por primera vez en Lactobacillus plantarum (Lonvaud, 1975; Schütz y Radler, 1973). Se presenta en todas las especies de bacterias lácticas aisladas de vinos.
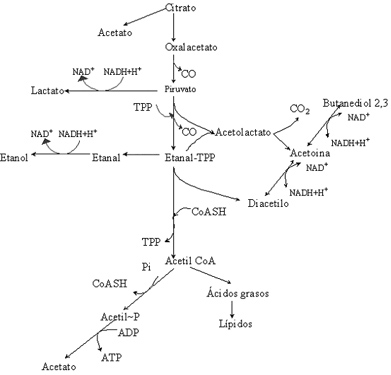
El ácido cítrico está presente en vinos en concentraciones entre 0,1-1 g/L. Las bacterias lácticas del vino lo escinden en una molécula de oxalacetato y otra de acetato mediante la citrato liasa. El oxalacetato es descarboxilado a continuación para dar piruvato, en el caso de O. oeni, o para dar succinato o formiato en el de ciertas especies de Lactobacillus. El piruvato es fuente de compuestos acetoínicos tales como: diacetilo, acetoína, y 2,3-butanodiol, siendo el primero de ellos particularmente importante desde el punto de vista organoléptico, dando aroma a mantequilla (fig. 2). Este aroma es beneficioso en los vinos siempre y cuando no sobrepase determinados límites. La intensidad aromática de los otros dos compuestos es muy inferior a la del diacetilo. Además de formar estas sustancias acetoínicas, el piruvato derivado del ácido cítrico es fuente de otros productos finales, como lactato, etanol o acetato (fig. 2). Como conclusión de lo expuesto se puede afirmar que existe un gran número de productos finales derivados del metabolismo del ácido cítrico. En cualquiera de los casos se produce más de una molécula de ácido acético por cada molécula de ácido cítrico consumida. La producción del resto de compuestos posibles está determinada por las condiciones de crecimiento de la bacteria; si éstas son limitantes (niveles reducidos de azúcar, bajo pH y presencia de inhibidores), se aumenta la producción de sustancias acetoínicas. La vía de formación de sustancias acetoínicas se considera un proceso de destoxificación para la célula, ya que para mantener su pH intracelular debe eliminar piruvato. Por el contrario, cuando las condiciones de crecimiento son buenas, las cantidades de ácido acético producidas son muy elevadas (Ribéreau-Gayon et al., 2000a).
Aunque la capacidad de degradar ácido tartárico no está muy extendida entre las bacterias lácticas, el catabolismo de este ácido siempre es perjudicial para el vino porque hace disminuir la acidez fija y aumentar la acidez volátil. Se han descrito varias cepas de diferentes especies de Lactobacillus capaces de catabolizar este ácido y se ha observado que esta característica es variable entre las cepas de una misma especie. Se han postulado dos vías catabólicas para el ácido tartárico, en función de la estequiometría de la reacción determinada empíricamente en dos especies, Lactobacillus plantarum y L. brevis (fig. 3).
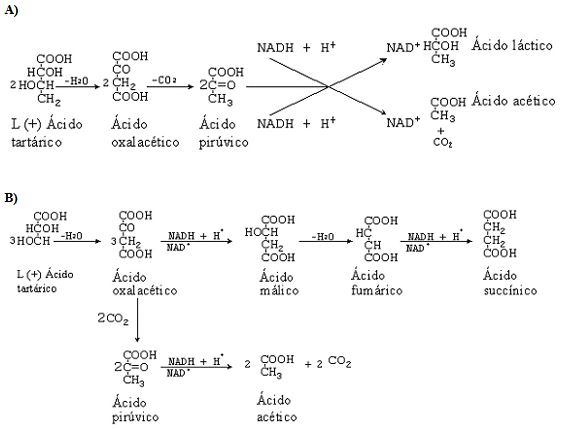
A) Ruta presente en Lactobacillus plantarum.
B) Ruta presente en la especie Lactobacillus brevis. (Extraída de Sponholz, 1993.)
Algunas bacterias lácticas también son capaces de metabolizar los aminoácidos que hay en el mosto o en el vino y de dar lugar a aminas biógenas o a precursores del carbamato de etilo, ambos productos son considerados peligrosos para la salud humana Las aminas biógenas son indeseables en todos los alimentos y bebidas porque absorbidas en alta concentración pueden producir dolores de cabeza, alteraciones respiratorias, palpitaciones cardíacas, hiper o hipotensión y fenómenos de alergia. Por su parte, el carbamato de etilo es considerado como un compuesto cancerígeno.
Las aminas biógenas se producen por descarboxilación de los aminoácidos (fig. 4) (Lonvaud Funel, 2001). Esta reacción conlleva ventajas para las bacterias lácticas, en primer lugar supone un aumento de pH del vino y, en segundo, una ganancia energética. El aumento del pH del vino mejora las condiciones de crecimiento para las células. La ganancia de energía derivada de la formación de aminas biógenas se debe a la creación de una fuerza protón-motriz capaz de formar ATP.
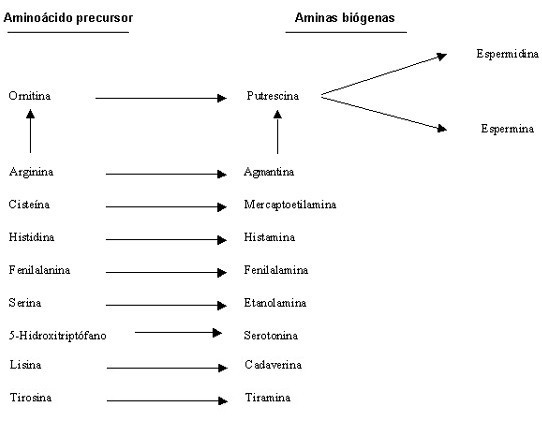
Generalmente se ha considerado a las cepas del género Pediococcus muy peligrosas por su capacidad de formar histamina. Sin embargo, Landete et al. (2003) demostraron que estas bacterias son mucho más inocuas que las pertenecientes a otros géneros presentes en vino. Así, estos autores demostraron que el 75 % de las cepas O. oeni analizadas eran productoras de histamina. Estos datos son concordantes con los que han publicado otros autores (Lonvaud y Joyeux, 1994; Coton et al., 1998a; Guerrini et al., 2002). También se ha puesto de manifiesto que O. oeni también produce putrescina y cadaverina, aunque estas actividades son poco frecuentes (Guerrini et al., 2002). El grupo de los lactobacilos heterofermentativos también se ha mostrado como importante productor de aminas biógenas, ya que el 88 % de las cepas analizadas por Landete et al. (2003) eran productoras de tiramina y feniletilamina. Por el contrario tan sólo un 5 % de los lactobacilos homofermentativos son productores de aminas.
El hecho de que tras la fermentación alcohólica y durante la fermentación maloláctica se detecten preferentemente especies de lactobacilos heterofermentadores y O. oeni explicaría el aumento de los niveles de aminas biógenas que se observan en ese período. La connotación tecnológica que tiene este hecho es importante, ya que si esta fermentación es llevada a cabo por cepas seleccionadas de O. oeni incapaces de generar aminas biógenas, se disminuyen considerablemente los riesgos que implica la realización de la misma por las cepas naturales.
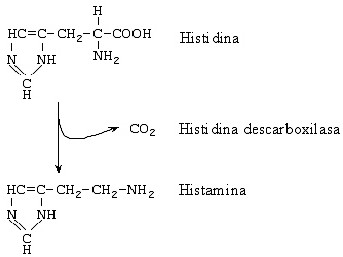
Aunque la putrescina y la cadaverina son las aminas que se encuentran en mayor concentración en los vinos, se le ha prestado más importancia a la histamina debido a que ejerce efectos tóxicos en el hombre a concentraciones más bajas que las otras. La histamina se forma por descarboxilación de la histidina en presencia de la histidina descarboxilasa (fig. 5). Por ello, dos de los factores que van a determinar su concentración en los vinos son la concentración del aminoácido precursor y la presencia de bacterias que tengan el enzima descarboxilante. A su vez la cantidad del aminoácido va a estar influenciada por ciertas prácticas enológicas, tales como el grado de maceración con los hollejos o el contacto prolongado del vino con las lías, que provoca un enriquecimiento del vino en proteínas y aminoácidos. La capacidad para producir histamina (al igual que las otras aminas biógenas) es un carácter asociado a cepa. Se ha demostrado que todas las cepas que presentan el gen hdc tienen actividad histidina descarboxilasa (Coton et al., 1998a; Landete et al., 2002), lo que ha permitido desarrollar sistemas moleculares de detección de cepas histaminogénicas, basadas en el uso de sondas para hibridación o PCR específica para ese gen (Coton et al., 1998a; Le Jeune et al., 1995; Landete et al., 2002).
La arginina es uno de los aminoácidos principales en el mosto y el vino. Su concentración en mostos está, generalmente, entre 0,1-2,4 g/L, pudiendo llegar a alcanzar los 10 mg/L durante toda la fermentación, mientras que al final de la misma se encuentra en cantidades que varían entre 0,1 a 2,3 g/L. La arginina, además de ser el origen de la agmantina y putrescina, puede ser desaminada dando lugar a citrulina que es un precursor del carbamato de etilo. Las bacterias pueden desaminar este aminoácido por distintas vías, pero en el caso de las bacterias lácticas la más frecuente es la vía de la deiminasa. Esta vía comprende la actuación de tres enzimas: arginina deiminasa (ADI) que transforma la arginina en citrulina; ornitina carbamoil transferasa (OTC), que convierte la citrulina en ornitina y carbamoil fosfato, y carbamato quinasa (CK) que transforma el carbamoil fosfato en CO2 y NH3. Por tanto, los productos finales de la degradación completa de la arginina son ornitina, CO2 y NH3. Liu et al. (1995) no encontraron actividad alguna de estos enzimas ni en lactobacilos homofermentativos ni en pediococos aislados de vino, lo que concuerda con su incapacidad para degradar arginina. La mayor parte de las cepas de O. oeni muestran actividad de los tres enzimas de la vía deiminasa, aunque algunas pocas muestran únicamente actividades OTC y CK. Al igual que en el caso de O. oeni, la mayoría de lactobacilos heterofermentativos presentan actividades ADI, OTC y CK que se expresan en alto grado (Liu y Pilone, 1998).
Liu et al (1996) demostraron que la cepa OENO de Leuconostoc oenos (O. oeni) y la cepa CUC-3 de Lactobacillus buchneri eran capaces de excretar como citrulina del 7-28 % de la arginina presente en vino. Mientras que la citrulina excretada era reutilizada por la cepa de L. buchneri, no lo era por la de O. oeni. Una razón que explicaría la excreción de citrulina sería el que exista un desequilibrio entre una elevada actividad del enzima ADI y una baja o nula actividad del enzima OTC. Se desconocen las causas que impiden a la cepa OENO reasimilar la citrulina. La excreción de citrulina al vino tiene importantes implicaciones enológicas. Una de las principales es la formación de carbamato de etilo como consecuencia de la reacción entre el etanol y la citrulina. Aunque los niveles de citrulina en el vino son bajos, pueden traducirse en concentraciones de carbamato de etilo superiores a 15 ng/L que es el límite voluntariamente establecido para este compuesto.
Existe todavía una controversia sobre la influencia de la fermentación maloláctica en la formación de carbamato de etilo; así, mientras unos autores han demostrado que no hay formación de éste durante la fermentación maloláctica llevada a cabo por O. oeni, otros han demostrado lo contrario. Liu et al. (1994) comprobaron que existía una buena correlación entre la degradación de arginina, la producción de citrulina y la formación de carbamato de etilo durante la fermentación maloláctica realizada en un vino de laboratorio inoculado con O. oeni.
Por esa razón, los programas de selección de cepas malolácticas deberían incluir como criterio que las cepas seleccionadas sean incapaces de excretar citrulina a partir de la arginina. Particularmente peligrosas son aquellas cepas que tienen únicamente el enzima ADI pero no el enzima OTC, o aquellas que presentando ambos enzimas exhiben una actividad OTC muy baja.
Las bacterias lácticas del vino alternan períodos de desarrollo activo con períodos de regresión. Durante los períodos de crecimiento, las bacterias utilizan los sustratos del vino para su desarrollo. Estos sustratos dan lugar a productos finales que pueden modificar las características organolépticas de los vinos. De todas las actividades metabólicas que las bacterias lácticas pueden llevar a cabo en el vino, la única deseada es la fermentación maloláctica, que es beneficiosa para disminuir la excesiva acidez de los vinos. El resto de las actividades conducen generalmente a alteraciones del vino tales como, el picado láctico (excesiva producción de ácido láctico y o acético por fermentación de los azúcares), vuelta manítica (producción de manitol a partir de la fructosa por las bacterias lácticas heterofermentativas), ahilado o grasa (formación de polisacáridos en el vino que le dan aspecto oleoso o viscoso), olor a mantequilla (ocasionada por un exceso de diacetilo producido a partir del ácido cítrico o del piruvato), olor a ratón (formación de 2-acetiltetrahidropiridina), amargor (transformación del glicerol en acroleína que combinada los antocianos da sensación de amargor), vuelta tartárica (degradación de ácido tartárico que origina ácido láctico o succínico, acético y CO2), olor a geranio ( formación de 2-etoxi-3,5-hexadieno a partir del ácido sórbico) (Sponholz, 1993) y formación de aminas biógenas (Lonvaud Funel, 2001; Ribéreau-Gayon et al., 2000a).
Bibliografía
Cabanis J.C., Cabanis M.T., Cheynier, V. Teissendre P.L.: «Tablas de composición. En “Enología: fundamentos científicos y tecnológicos». En: C. Flanzy (ed.): 218-231, AMV Ediciones y Mundi Pressa. Madrid, 2000.
Coton E., Rollan G., Bertrand A., Lonvaud-Funel A.: «Histamine-producing lactic acid bacteria in wines: early detection, frequency, and distribution», Am J Enol Vitic 1988a ; 49: 199-204.
De Vries W., Kapteijn W.M.C., Van der Beek E.G., StouthamerA.H.: «Molar growth yields and fermentation balances of Lactobacillus casei L3 in batch cultures and in continuous cultures», J Gen Microbiol 1970; 63: 333-345.
Guerrini S., Mangani S., Granchi L., Vincenzini M.: «Biogenic amine production by Oenococcus oeni», Current Microbiol 2002; 44: 374-378.
Landete J.M., Ferrer S., Pardo I.: «Producción de aminas biogénicas por bacterias lácticas de origen enológico», VI Jornadas Científicas de los Grupos de Investigación Enológica. Valencia. Libro de Actas, pp. 277-281. Editorial de la Universidad Politécnica de Valencia, Valencia, 2003.
Landete J.M., Ferrer S., Pardo I.: «Correlation between histidine decarboxilase activity and the presence of hdc gene», Xth International Congress of Bacteriology and Applied Microbology. París, Abstract book pp. 132, 2002.
Le Jeune C., Lonvaud-Funel A., Ten Brink B., Hofstra H., Van der Vossen J.M.B.M.: «Development of a detection system for histidine decarboxylating lactic acdi bacteria based on DNA probes, PCR and activity test», J Appl Bacteriol 1995; 78: 316-326.
Liu S.-Q., Pilone G.J.: «A review: arginine metabolism in wine lactic acid bacteria and its practical significance», J Appl Bacteriol 1998; 84: 315-327.
Liu S.-Q., Pritchard G.G., Hardman M.J., Pilone G. J.: «Citrulline production and ethyl carbamate (urethane) precursor formation form arginine degradation by wine lactic acid bacteria Leuconostoc oenos and Lactobacillus buchneri», Am J Enol Vitic 1994; 45: 235-242.
Liu S.-Q., Pritchard G.G., Hardman M.J., Pilone G.J.: «Occurrence of arginine deiminase pathway enzymes in arginine catabolism in wine lactic acid bacteria», Appl Environ Microbiol 1995; 61: 310-316.
Lonvaud M.: Thèse Doctorat 3ème cycle, Universiè de Bordeaux II, 1975.
Lonvaud-Funel A., Joyeux A.: «Histamine production by wine lactic acid bacteria: isolation of a histamine-producing strain of Leuconostoc oenos», J Appl Bacteriol 1994; 77: 401-407.
Ribéreau-Gayon P., Dubordieu D., Donèche B., Lonvaud A.: Handbook of Enology Vol. 1: The microbiology of wine and vinifications, John Wiley & Sons Ltd., 2000a.
Ribéreau-Gayon P., Glories Y., Maujean A., Dubourdieu D.: Handbook of Enology Vol. 2: The chemistry of wine. Stabilization and treatments, Londres, John Wiley & Sons Ltd., 2000b.
Schütz M., Radler F.: «Das ‘Malatenzym’ von Lactobacillus plantarum und Leuconostoc mesenteroides», Arch Mikrobiol 1973; 91: 183-202.
Sponholz W.-R.: «Wine Spoilage by Microorganisms», En: G.H. Fleet: Wine Microbiology and Biotecnology (ed.), Suiza, Hardwood Academic Publishers, 1993: 395-420.
Thomas T.D., Ellwood D.C., Longyear V.M.C.: «Change from homo to heterolactic fermentation by Streptococcus lactis resulting from glucose limitation in anaerobic chemostat cultures», J Bacteriol 1979; 138: 109-117.
Thompson J., Gentry-Weeks C.R.: «Métabolisme des sucres par les bactéries lactiques», En: Roissart H., Luquet F.M. (eds.): Bactéries Lactiques. Vol I, Lorica, Francia, 1994: 239-290.