Introducción
La Patagonia argentina es una de las regiones vitivinícolas más australes del mundo (38 a 45º de latitud sur).
Los viñedos, de baja altitud, se asientan mayoritariamente en las márgenes de los ríos Negro y Colorado, un extenso valle que nace a los pies de la cordillera de los Andes. La región combina una tradición productiva centenaria con condiciones agroecológicas y climáticas excepcionales, que permiten la producción de vinos de alta gama. Desde el punto de vista edáfico los suelos son coluviales y aluviales, originados por erosión fluvial y eólica. Los días resultan templados y luminosos y las noches frescas, con apreciable amplitud térmica. Los vientos, fuertes y constantes, acompañan la lenta maduración de las uvas y evitan la aparición de enfermedades criptogámicas, posibilitando así la producción de vinos orgánicos. Estos factores geográficos y climáticos, sumados a las variedades de uva y las prácticas locales de cultivo y vinificación, influyen en la composición de las comunidades bacterianas y fúngicas de suelo, rizósfera y vides1-3 que, en conjunto, modulan las características de los vinos patagónicos, diferentes a los del resto de Argentina.
La región patagónica produce mayoritariamente vinos tintos jóvenes y secos y, en menor medida, blancos; malbec, merlot, cabernet sauvignon y pinot noir son las variedades más destacadas. La caracterización fisicoquímica de mostos tintos patagónicos evidencia un elevado contenido de ácidos orgánicos fijos respecto de mostos similares de otras regiones de Argentina y del mundo, en particular de ácido L-málico,4 que puede alcanzar el 66% de la acidez titulable (45% de acidez total) en pinot noir.5
«La mayoría de las bodegas patagónicas realizan fermentaciones malolácticas espontáneas, guiadas por la comunidad nativa de bacterias lácticas, proceso que resulta impredecible, especialmente con temperaturas bajas.»
En el caso particular de la elaboración de vinos tintos, la mayoría de las bodegas patagónicas realizan fermentaciones malolácticas (FML) espontáneas, guiadas por la comunidad nativa de bacterias lácticas (BL). Este proceso resulta impredecible, especialmente con temperaturas bajas, razón por la cual disponer de cultivos indígenas/autóctonos que mantengan las características del terroir regional y permitan obtener vinos de calidad se convierte en una herramienta estratégica.
Desde hace varios años nuestro grupo de investigación se dedica al estudio de BL enológicas de la Patagonia argentina, en la búsqueda de las mejores cepas para la formulación de cultivos iniciadores malolácticos nativos. A continuación se resumen nuestros últimos aportes con relación a su diversidad genética, a los criterios aplicados en la selección de cepas y a las capacidades de cepas de las especies Oenococcus oeni y Lactobacillus plantarum para modificar el perfil de compuestos volátiles del vino.
Fermentaciones malolácticas espontáneas en vinos patagónicos
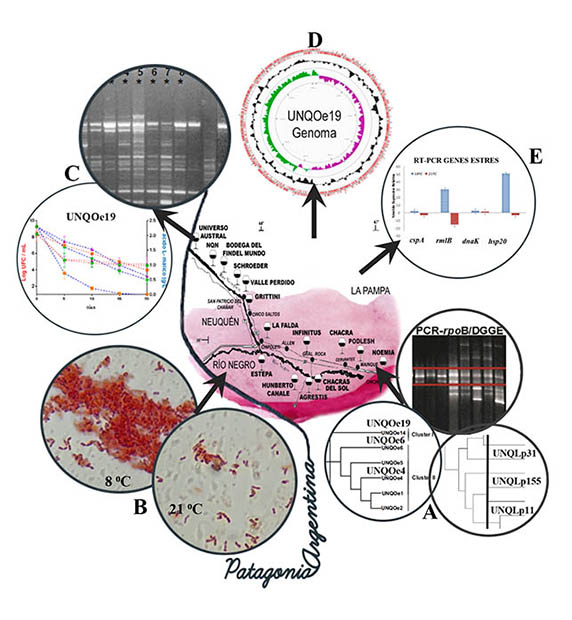
Por métodos dependientes e independientes de cultivo se observó que fermentaciones espontáneas exitosas de vinos patagónicos de las variedades pinot noir y merlot involucraban, en sus primeras etapas, a numerosas especies como L. plantarum, L. sakei, L. casei, L. paracasei, L. brevis, L. delbrueckii, L. guizhouensis, L. rhamnosus, Pediococcus ethanolidurans, P. acidilactici, P. pentosaceus, Leuconostoc mesenteroides y O. oeni, entre otras.6 Al avanzar el proceso de vinificación, se verificaba una selección natural, con considerable reducción de la diversidad de especies, prevaleciendo L. plantarum y O. oeni como protagonistas principales de FML exitosas.6-8 También se comprobó la existencia de una considerable diversidad genética tanto entre las cepas de L. plantarum como entre las de O. oeni6 (fig. 1A).
O. oeni es probablemente la especie mejor adaptada para resistir las condiciones estresantes del vino, y se la ha señalado como principal protagonista de la FML en diferentes regiones enológicas del mundo.9-12 Sin embargo, L. plantarum es una especie de BL adaptable a diferentes ambientes y numerosas cepas poseen mecanismos de resistencia que las capacitan para proliferar en vino, convirtiéndolas en potenciales iniciadores (starters) para FML.6,8,13-20 Se ha demostrado asimismo su capacidad de consumir el ácido L-málico en vinificaciones de diferentes varietales tintos y de producir metabolitos relevantes en la formación del aroma secundario del vino.17,18
Cepas patagónicas psicrotróficas
La vinificación de uvas tintas en la región patagónica se realiza durante marzo y abril, meses con temperaturas ambientales relativamente bajas (entre 8 y 18 °C), que afectan el normal desarrollo de FML espontáneas. Las BL son microorganismos mesófilos, con temperaturas óptimas de crecimiento de 22 a 28 °C.
Las bodegas regionales afrontan el problema calentando los tanques y/o el ambiente de fermentación, lo que supone un incremento significativo de los costos de producción. Cuando las BL se exponen a ambientes fríos, las células sufren cambios fisiológicos significativos, como disminución de la fluidez de la membrana plasmática y formación de estructuras secundarias en DNA y RNA, con reducida eficacia de los procesos de traducción, transcripción y replicación.21 La respuesta bacteriana al estrés térmico, denominada cold-shock response, induce la síntesis de diversas proteínas CIP (cold-induced proteins) que actúan sobre la fluidez de la membrana, el superenrollamiento del DNA, la transcripción y la traducción, facilitando la adaptación bacteriana a ambientes hostiles.22-26
«En regiones vitivinícolas de climas fríos, la baja temperatura ambiental emerge como un elemento de estrés añadido a la concentración de etanol, porque inhibe o retrasa el normal desarrollo de la FML.»
Tanto O. oeni como L. plantarum son capaces de expresar proteínas de respuesta a estrés por baja temperatura, desconociéndose aún la totalidad de los diferentes mecanismos de adaptación que intervienen. Si bien la concentración de etanol del vino se considera como el principal factor de estrés para las bacterias, en regiones vitivinícolas de climas fríos la baja temperatura ambiental emerge como un segundo elemento de estrés, porque inhibe o retrasa el normal desarrollo de la FML.
Con el propósito de hallar una solución sustentable para las vinificaciones a temperaturas subóptimas, como las que ocurren con frecuencia en la Patagonia argentina, nuestro grupo diseñó estrategias de aislamiento de cepas nativas psicrotróficas, mediante presión selectiva de baja temperatura, que pudieran destinarse a la formulación de cultivos iniciadores malolácticos. Partiendo de vinos pinot noir en FML espontánea se obtuvo una colección de cepas de O. oeni (fig. 1B) y de L. hilgardii, y se observó una elevada heterogeneidad genética en ambas especies. La recuperación mayoritaria de aislamientos de L. hilgardii en esta condición surgió como una novedad respecto de los hallazgos previos de diversidad de especies en FML espontáneas de vinos pinot noir y merlot patagónicos.6 Por otra parte, y a partir de la colección de BL patagónicas de nuestro Laboratorio de Microbiología Molecular, también se pudieron recuperar cepas psicrotróficas de L. plantarum.
Mediante ensayos de inoculación en un vino pinot noir estéril, que se incubó a bajas temperaturas (4 y 10 °C), se comprobó que las cepas psicrotróficas de O. oeni, L. plantarum y L. hilgardii exhibían diferentes capacidades, tanto para sobrevivir como para consumir ácido L-málico. Estos valores se utilizaron como criterios para seleccionar las cepas con mejor desempeño, con las que se realizaron FML de un vino pinot noir no estéril, también incubado a baja temperatura (4 y 10 °C), y se analizó su capacidad de implantación en presencia de la microbiota nativa y su habilidad para desarrollar la fermentación (fig. 1C). Las cepas ensayadas mostraron buena capacidad de implantación y lograron conducir la FML, sugiriendo la posibilidad de su empleo como cultivos iniciadores para fermentaciones a baja temperatura (fig. 1C).27 En las cepas seleccionadas también se controló la ausencia de genes involucrados en la síntesis de las aminas biógenas (AB) histamina y putrescina, genes hdc (histidina descarboxilasa) y ptc (putrescina carbamoil transferasa). Resta investigar la ausencia de genes involucrados en la síntesis de otras AB, como tiramina y cadaverina, así como evaluar el posible contenido de AB en los vinos obtenidos por inoculación de las cepas seleccionadas.
«La formación de la matriz, junto a la expresión de genes de respuesta a estrés, permitiría la adaptación e implantación de estos cultivos para ser inoculados en vinos que fermentan a baja temperatura ambiente.»
Con el propósito de interpretar la respuesta adaptativa de estas cepas psicrotróficas a temperaturas subóptimas, se obtuvo el genoma ensamblado completo de la cepa UNQOe19 de O. oeni, que exhibió la mejor capacidad de adaptación para vinificaciones en frío a escala de laboratorio (fig. 1D). Su análisis reveló la existencia de una variedad de enzimas con posible acción positiva sobre las propiedades sensoriales del vino. Comparando su anotación genómica con la de la cepa PSU-1 de O. oeni, se detectaron 160 genes únicos, entre los cuales resulta interesante mencionar los relacionados con la homeostasis, con la respuesta a estrés y con la síntesis de exopolisacáridos.28 Esta última facultad explicaría la detección de una matriz extracelular alrededor de las bacterias de la cepa UNQOe19 (fig. 1B), más notable cuando las células se inoculan en un vino incubado a 4 °C, y reducida ante incrementos de la temperatura de incubación. Este hallazgo sugiere que la formación de la matriz, junto a la expresión de genes de respuesta a estrés, permitiría la adaptación e implantación de estos cultivos para ser inoculados en vinos que fermentan a baja temperatura ambiente.
En dos de las cepas psicrotróficas patagónicas de O. oeni (UNQOe19 y UNQOe4) se analizó la expresión relativa de los genes de respuesta a estrés rmlB y hsp20, comparando una aclimatación de 48 horas a dos temperaturas (18 y 21 °C) y la posterior incubación de los cultivos en un vino pinot noir estéril por 25 días, para investigar la influencia de la temperatura de aclimatación en la supervivencia celular y en su performance durante la fermentación29 (fig. 1E). Dependiendo de qué aclimatación se realizara a 18 o a 21 °C, el consumo de ácido L‑málico, la población sobreviviente y el comportamiento transcripcional resultaron diferentes. Los genes rmlB y hsp20 mostraron un considerable incremento en su nivel de expresión cuando ambas cepas psicrotróficas se aclimataron a 18 °C, y esto podría explicar la mejor supervivencia en el vino y el mayor consumo de ácido L-málico respecto de las células aclimatadas a 21 °C. Estos resultados sugieren que el análisis de la expresión génica de células aclimatadas a temperaturas subóptimas podría constituir un buen criterio de selección de cepas psicrotróficas destinadas a cultivos iniciadores.
Modificación del perfil de compuestos volátiles de vinos patagónicos inoculados con cepas nativas seleccionadas de O. oeni y L. plantarum
El aroma es una de las principales características ligadas a la calidad de un vino y a las preferencias de los consumidores. Las prácticas vitícolas y las tecnologías aplicadas en la producción de vino se orientan a fomentar características aromáticas positivas, eliminando o minimizando los defectos aromáticos (off-flavors), con el propósito de lograr vinos de gran calidad.30 El aroma del vino es el resultado de una larga secuencia de transformaciones químicas y bioquímicas, que se inician en la uva con la síntesis de precursores aromáticos y de ciertas moléculas que tendrán impacto en el aroma varietal de muchos vinos; continúa con la generación de nuevos compuestos odorantes durante las fermentaciones alcohólica (FA) y FML, a partir de precursores no odorantes del mosto, y culmina con la génesis del aroma terciario durante la maduración y el envejecimiento.30
Las diferentes variedades de uva, las condiciones de cultivo, las ambientales, los microorganismos implicados y la tecnología de elaboración del vino son factores con incidencia directa en el aroma y, dependiendo de la combinación de los mismos, pueden obtenerse vinos con características aromáticas muy diferentes. El control de las fermentaciones (FA y FML) mediante temperatura, nutrientes, microorganismos, etc. resulta relevante en la producción de compuestos del aroma con implicación positiva en las características sensoriales de los vinos, y evita la formación de compuestos volátiles que deprecian el aroma del vino.
El perfil aromático del mosto cambia notablemente durante y tras ambas fermentaciones. Distintas especies y cepas de BL poseen enzimas que intervienen en varias rutas metabólicas relacionadas con modificaciones del perfil aromático del vino.
En una colección de cepas nativas patagónicas de O. oeni y L. plantarum se analizó la presencia de genes involucrados en la producción de compuestos del aroma7,8,31 y/o de actividades enzimáticas relacionadas con las propiedades organolépticas del vino (actividad tanasa, consumo de citrato, actividad b-glucosidasa, etc.).7,31 Más recientemente, se emplearon técnicas analíticas como microextracción en fase sólida HS-SPME (head space-solid phase microextraction) y cromatografía de gases acoplado a espectroscopia de masa GC-MS (chromatography-mass spectrometry), como nuevos criterios de selección relacionados con la transformación del perfil sensorial de vinos por inoculación de cepas nativas en diferentes varietales tintos.
En ensayos de fermentación de vino pinot noir estéril a escala de laboratorio, se pudo observar una disminución de los alcoholes, principales compuestos volátiles al final de la FA, y un incremento en la concentración de ésteres volátiles (tabla 1). La cepa UNQOe73.2, de O. oeni, causó la modificación más notable del perfil volátil, con producción de ciertos ésteres odorantes en elevada concentración, comparado con la cepa UNQOe31b. Si bien la cepa UNQLp11, de L. plantarum, mostró mejor rendimiento para consumir el ácido L-málico y exhibió menor capacidad para modificar el perfil de compuestos volátiles del vino.17,19
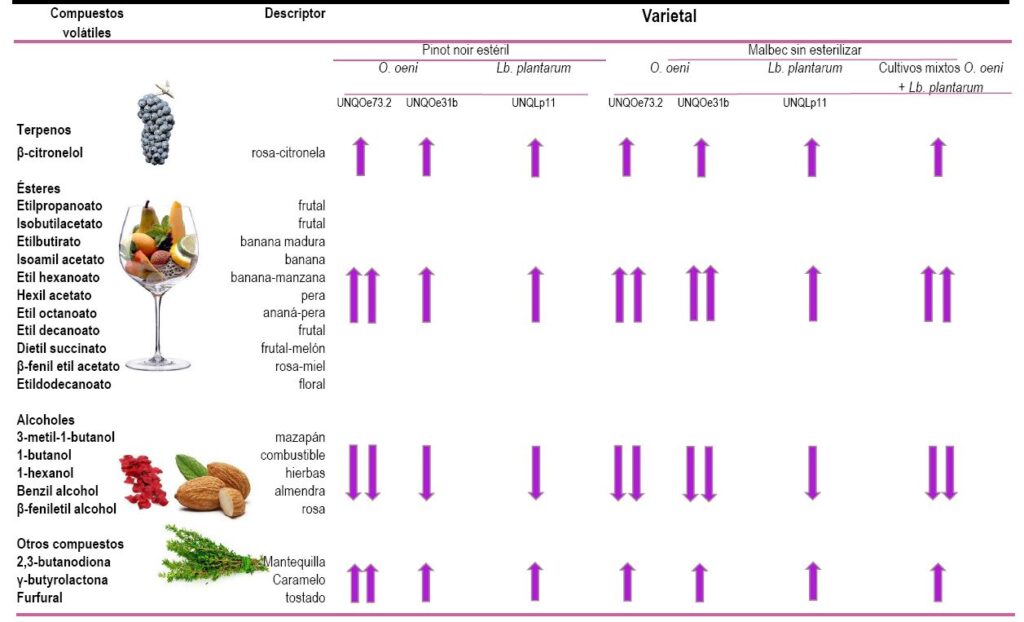
Siendo el malbec el varietal insignia de Argentina, y el más producido en la Patagonia, resultó de interés estudiar el efecto de inocular, en un vino sin esterilizar, cultivos de L. plantarum (UNQLp11) y de O. oeni (UNQOe31b y UNQOe73.2), así como mezclas de ambos, para analizar su capacidad de conducir la FML a escala de laboratorio y de modificar el perfil volátil (tabla 1).
Nuevamente se pudo comprobar que los cultivos de O. oeni resultaban los de mayor potencial para producir ésteres, responsables de aromas frutales y florales, y que la inclusión de cepas de L. plantarum en los cultivos mixtos de varias BL garantizaba un mayor consumo de ácido L-málico.18 Este resultado sugiere que el empleo de cultivos mixtos para inducir la FML podría ofrecer una innovación interesante para aplicar en el proceso de vinificación, destinada a mejorar los atributos sensoriales y la calidad final del vino.
| Conservación de cultivos nativos patagónicos
Los procesos de conservación de BL, como congelación y liofilización, implican disminución de la actividad de agua celular y pérdida de viabilidad, siendo la membrana plasmática el primer blanco de daño. Para prevenirlo, se adicionan compuestos protectores, como azúcares y/o aminoácidos, que incrementan la recuperación bacteriana después de la conservación. En el caso de cultivos nativos patagónicos de cepas de L. plantarum y de O. oeni, se utilizó exitosamente la trehalosa como crioprotector, en procesos de congelación y de liofilización. Considerando que los cultivos conservados deben luego exponerse a las condiciones adversas del vino (bajo pH y elevadas concentraciones de etanol), en las que la existencia de daños subletales en membrana conduce a la muerte celular y al fracaso de la FML, también resultó importante analizar las condiciones de rehidratación de los cultivos conservados, previa a su inoculación. Asimismo, la aclimatación de cultivos (en condiciones subletales de pH y etanol), previa a la conservación, mostró ser crucial para la supervivencia celular y el consumo de ácido L-málico durante la incubación en vino.32,33 |
Conclusiones
Se comprobó que BL de las especies O. oeni y Lb. plantarum resultan poblaciones mayoritarias en FML espontáneas de vinos pinot noir y merlot patagónicos, y que algunas cepas son capaces de producir metabolitos de interés en la formación del aroma secundario del vino.
Asimismo se demostró que resultaba posible recuperar cepas psicrotróficas de ambas especies, y también de L. hilgardii, mediante adecuada presión de selección, dada la necesidad de este tipo de cultivos para conducir FML en la Patagonia argentina a temperaturas subóptimas.
También se comprobó que el comportamiento de BL nativas patagónicas, en los diferentes sistemas ensayados (vino sintético, vino estéril y vino sin esterilizar), resultaba dependiente de especie y cepa empleada.
La formulación de cultivos iniciadores nativos malolácticos requiere la caracterización y propagación de cepas comprobadamente adecuadas para tal fin, aplicando diferentes criterios de selección en cada etapa y considerando los posibles impactos innovadores positivos de estos recursos microbianos en la calidad y las propiedades sensoriales y funcionales del vino (innovación de producto).
En una próxima etapa nuestras investigaciones se orientarán a posibles mejoras de aplicación en la industria vitivinícola patagónica, basadas en recursos microbianos que permitan reducir tiempos/costos e impactos ambientales asociados a la vinificación (innovación de proceso).
Agradecimientos
Este trabajo se enmarca en programas y proyectos de investigación financiados por la Universidad Nacional de Quilmes (UNQ) (Programas Microbiología Molecular Básica y Aplicada 2011-2019 y Microbiología Molecular Básica y Aplicada a Agronomía, Alimentos y Salud 2019-2023), la Comisión de Investigaciones Científicas de la Provincia de Buenos Aires (CIC-BA), la Agencia Nacional de Promoción Científica y Tecnológica (ANPCyT) (PICTs 2014, 2016 y 2018), y el Programa I-COOP+ – CSIC de Cooperación Científica para el Desarrollo, Convocatoria 2017 CIC N.º 428/16.
NSB es Becaria Doctoral del Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), BMBF, NTO y EET son miembros de la Carrera de Investigador Científico y Tecnológico del CONICET. DVLH es miembro de la Carrera de Investigador Científico y Tecnológico de la CIC-BA. DVLH, LD y LS son Profesoras Investigadoras de la UNQ.
Bibliografía
1. Bokulich NA, Thorngate JH, Richardson PM, Mills DA. Microbial biogeography of wine grapes is conditioned by cultivar, vintage, and climate. PNAS 2014; 111: 139-48.
2. Bokulich NA, Collins TS, Masarweh C, Allen G, Heyman H, Ebeler SE, Mills DA. Associations among wine grape microbiome, metabolome, and fermentation behavior suggest microbial contribution to regional wine characteristics. mBio 2016; 7: 1-12.
3. Knight S, Klaere S, Fedrizzi B, Goddard M. Regional microbial signatures positively correlate with differential wine phenotypes: evidence for a microbial aspect to terroir. Scientific Reports 2015; 5: 14233.
4. Crisóstomo B. Caracterización fisicoquímica de mostos de uva de la Región Sur destinados a vinificación. Práctica para optar al título de Licenciada en Ciencias Químicas de Alimentos, Universidad Nacional de Córdoba (Directora: Dra. Adriana Caballero), 2007.
5. Lopes CA, Rodríguez ME, Sangorrín M, Querol A, Caballero AC. Patagonian wines: the selection of an indigenous yeast starter. J Indust Microbiol Biotechnol 2007; 34: 539-46.
6. Valdés La Hens D, Bravo-Ferrada BM, Delfederico L, Caballero A, Semorile L. Prevalence of Lactobacillus plantarum and Oenococcus oeni during spontaneous malolactic fermentation revealed by polymerase chain reaction-denaturing gradient gel electrophoresis with two targeted genes. Australian J Wine Grape Res 2015; 21: 49-56.
7. Bravo Ferrada BM, Hollmann A, Delfederico L, Valdés La Hens D, Caballero A, Semorile L. Patagonian red wines: selection of Lactobacillus plantarum isolates as potential starter cultures for malolactic fermentation. World J Microb Biot 2013; 29: 1537-49.
8. Brizuela NS, Bravo-Ferrada BM, Valdés La Hens D, Hollmann A, Delfederico L, Caballero AC, Tymczyszyn EE, Semorile L. Comparative vinification assays with selected Patagonian strains of Oenococcus oeni and Lactobacillus plantarum. LWT – Food Sci Technol 2017; 77: 348-55.
9. Reguant C, Carreté R, Constantí M, Bordons A. Population dynamics of Oenococcus oeni in a new winery and the effect of SO2 and yeast strain. FEMS Microbiol Lett 2005; 246: 111-7.
10. Izquierdo Cañas PM, Gómez Alonso S, Ruiz Pérez P, Seseña Prieto S, García Romero E, Palop Herreros M. Biogenic amine production by Oenococcus oeni isolates from malolactic fermentation of Tempranillo wine. J Food Protec 2009; 72: 907-10.
11. González-Arenzana L, Santamaría P, López R, Tenorio C, López-Alfaro I. Ecology of indigenous lactic acid bacteria along different winemaking processes of Tempranillo red wine from La Rioja (Spain). TSWJ 2012: 796327.
12. Miranda-Castilleja DE, Martínez-Peniche RA, Ladrete-Tapia JA, Soto-Muñoz L, Iturriaga MH, Pacheco-Aguilar JR, Arvizu-Medrano SM. Distribution of native Lactic Acid Bacteria in wineries of Querétaro, México and their resistance to wine-like conditions. Front Microbiol 2016; 7: 1769.
13. Mtshali S, Divol B, van Rensburg P, du Toit M. Genetic screening of wine-related enzymes in Lactobacillus species isolated from South African wines. J Appl Microbiol 2010; 108: 1389-97.
14. Testa B, Lombardi SJ, Tremonte P, Succi M, Tipaldi L, Pannella G, Sorrentino E, Iorizzo M, Coppola R. Biodiversity of Lactobacillus plantarum from traditional Italian wines. World J Microb Biotech 2014; 30: 2299-305.
15. Lucio O, Pardo I, Krieger-Weber S, Heras JM, Ferrer S. Selection of Lactobacillus strains to induce biological acidification in low acidity wines. LWT – Food Sci Technol 2016; 73: 334-41.
16. Iorizzo M, Testa B, Lombardi SJ, García Ruiz A, Muñoz González C, Bartolomé B, Moreno-Arribas MV. Selection and technological potential of Lactobacillus plantarum bacteria suitable for wine malolactic fermentation and grape aroma release. LWT – Food Sci Technol 2016; 73: 557-66.
17. Brizuela NS, Bravo-Ferrada BM, Pozo Bayón MA, Semorile L, Tymczyszyn EE. Changes in the volatile profile of Pinot noir wines caused by Patagonian Lactobacillus plantarum and Oenococcus oeni strains. Food Res Int 2018; 106: 22-8.
18. Brizuela NS, Bravo-Ferrada BM, Curilén Y, Delfederico L, Caballero A, Semorile LC, Pozo-Bayón MA, Tymczyszyn EE. Advantages of using blend cultures of native Lactobacillus plantarum and Oenococcus oeni strains to induce malolactic fermentation of Patagonian Malbec wine. Front Microbiol 2018; 9: 2109.
19. Brizuela NS, Tymczyszyn EE, Semorile L, Valdés La Hens D, Delfederico L, Bravo Ferrada BM. Lactobacillus plantarum as a malolactic starter culture in winemaking: a new (old) player? EJ Biotechnol 2019; 38: 10-8.
20. Berbegal C, Borruso L, Fragasso M, Tufariello M, Russo P, Brusetti L, Spano G, Capozzi V. A metagenomic-based approach for the caracterization of bacterial diversity associated with spontaneous malolactic fermentations in wine. Int J Mol Sci 2019; 20: 3980-4002.
21. Serrazanetti DI, Gottardi D, Montanari C, Gianotti A. Dynamic stresses of lactic acid bacteria associated to fermentation processes. En: J. Marcelino Kongo, ed. Lactic Acid Bacteria. R&D for ood, Health and Livestock Purposes. Londres: IntechOpen, 2013, cap. 13.
22. Spano G, Massa S. Environmental stress response in wine lactic acid bacteria: beyond Bacillus subtilis. Crit Rev Microbiol 2006; 32: 77-86.
23. Olguín NT, Bordons A, Reguant C. Multigenic expression analysis as an approach to understanding the behaviour of Oenococcus oeni in wine-like conditions. Int J Food Microbiol 2010; 144: 88-95.
24. Olguín NT, Champonier-Vergès M, Anglade P et al. Influence of etanol and pH on the gene expression of the citrate pathway in Oenococcus oeni. Food Microbiol 2015; 51: 87-95.
25. Mohedano ML, Russo P, de los Ríos V, Capozzi V, Fernández de Palencia P, Spano G, López P. A partial proteome reference map of the wine lactic acid bacterium Oenococcus oeni ATCC BAA-1163. Open Biol 2014; 4: 130154.
26. Darsonval M, Msadek T, Alexandre H, Grandvalet C. The antisense RNA approach: a new application for in vivo investigation of the stress response of Oenococcus oeni, a wine-associated lactic acid bacteria. Appl Environ Microbiol 2016; 82: 18-26.
27. Manera C, Olguín NT, Bravo-Ferrada BM, Tymczyszn EE, Delfederico L, Bibiloni H, Caballero AC, Semorile L, Valdés La Hens D. Survival and implantation of indigenous psychrotrophic Oenococcus oeni strains during malolactic fermentation in a Patagonian Pinot noir wine. LWT – Food Sci Technol 2019; 108: 353-60.
28. Iglesias NG, Valdés La Hens D, Olguín NT, Bravo-Ferrada BM, Brizuela NS, Tymczyszyn EE, Bibiloni H, Caballero AC, Semorile L. Genome sequence of Oenococcus oeni UNQOe19, the first fully assembled genome sequence of a Patagonian psychrotrophic oenological strain. MRA 2018; 7: 00889.
29. Olguín NT, Valdés La Hens D, Delfederico L, Semorile L. Relative expression of stress-related genes during acclimation at low temperature of psychrotrophic Oenococcus oeni strains from Patagonian wine. World J Microb Biotech 2018; 35:5.
30. Pozo Bayón M. Descifrando las claves químicas que explican el aroma del vino. ACENOLOGÍA 2005 (oct). Disponible en: ACENOLOGÍA.
31. Bravo-Ferrada BM, Hollmann A, Brizuela NS, Valdés La Hens D, Tymczyszyn EE, Semorile L. Growth and consumption of L-malic acid in wine-like medium by acclimated and non-acclimated cultures of Patagonian Oenococcus oeni strains. Folia Microbiol 2016; 61: 365-73.
32. Bravo-Ferrada BM, Brizuela NS, Gerbino E, Gómez-Zavaglia A, Semorile L, Tymczyszyn EE. Effect of protective agents and previous acclimation on ethanol resistance of frozen and freeze-dried Lactobacillus plantarum strains. Cryobiology 2015; 71: 522-8.
33. Bravo-Ferrada BM, Gonçalves S, Semorile L, Santos NC, Brizuela N, Elizabeth Tymczyszyn E, Hollmann A. Cell surface damage and morphological changes in Oenococcus oeni after freeze-drying and incubation in synthetic wine. Cryobiology 2018; 82:15-21.