Los metales pesados, en especial el cobre, tienen un gran impacto en el procesado de la uva y la elaboración del vino. Las fuentes de cobre en enología son diversas: el suelo de los viñedos, los pesticidas basados en cobre, el instrumental utilizado, y la adición exógena para contrarrestar la reducción de los vinos. El cobre puede retrasar la fermentación del mosto por las levaduras, disminuyendo el consumo de azúcares y, por tanto, la producción de etanol. Además, el cobre ejerce un impacto negativo en la calidad sensorial del vino, provocando una sensación metálica. Por otro lado, la industria enológica tiene que ajustarse a las demandas de los organismos correspondientes, que limitan la concentración de cobre permitida tanto en suelos y mostos, como en el vino. Existen varias estrategias permitidas para la eliminación del cobre excedente en el vino, pero que pueden alterar las propiedades organolépticas del mismo y ser poco saludables. La utilización de levaduras para este fin está cobrando gran interés, además de ser un método ecológico y sostenible. Este texto pretende aportar una mejor comprensión del impacto del cobre en la elaboración de vino y el interés en la utilización de levaduras para la obtención de vinos con un menor contenido de cobre.
Importancia biológica del cobre
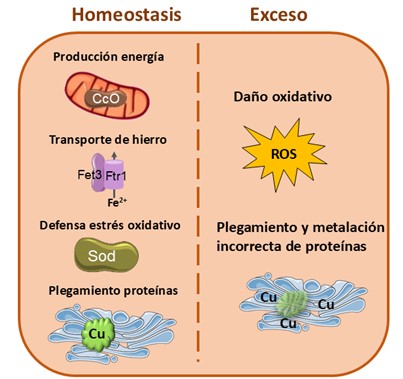
El cobre es un micronutriente esencial debido a que está involucrado en múltiples procesos metabólicos de los seres vivos. Está presente mayoritariamente en dos estados de oxidación fácilmente intercambiables entre sí debido a su potencial redox: su estado reducido (ion cuproso Cu+) y su estado oxidado (ion cúprico Cu2+). Estas propiedades redox le permiten participar como cofactor en varios enzimas: la citocromo C oxidasa (CcO) de la cadena de transporte electrónico mitocondrial; la superóxido dismutasa (SOD), clave en la protección frente al estrés oxidativo; y una familia de ferroxidasas esenciales para el transporte y distribución de hierro, como Fet3 (Festa & Thiele, 2011), (Figura 1). Además, el cobre también tiene un papel fundamental en la estabilización de proteínas, señalización celular, expresión génica y otros procesos biológicos. La deficiencia de cobre se relaciona con enfermedades cardiovasculares y neurodegenerativas, anemia, y otros trastornos (Chen et al., 2020). No obstante, el cobre también puede resultar tóxico cuando se encuentra en exceso, ya que participa en reacciones de tipo Fenton que dan lugar a especies reactivas del oxígeno (ROS) capaces de dañar los componentes celulares. Además, un exceso de cobre también puede provocar alteraciones en el plegamiento de las proteínas, dando lugar a agregados tóxicos (Festa & Thiele, 2011). De hecho, en humanos, el exceso de cobre se relaciona con enfermedades neurodegenerativas, hepatitis, cáncer, aterosclerosis e hipertensión (Chen et al., 2020). El exceso de cobre también es perjudicial cuando se acumula en ecosistemas, contaminando suelo cultivable y acuíferos, provocando una disminución de la biodiversidad (Wang et al., 2023).
Fuente de cobre en enología
El contenido de cobre en las uvas, el mosto y el vino está estrictamente limitado en la Unión Europea. Se estipuló un uso máximo anual de plaguicidas de cobre en suelos de viñedos de 6 kg/ha/año, mientras que los límites máximos de residuos (LMR) de cobre en el suelo de los viñedos, el mosto y el vino se fijaron en 140 mg/kg, 20 mg/L y 1 mg/L, respectivamente (EC.1410/2003, 2003). La Organización Internacional de la Viña y el Vino (OIV) también fijó LMR similares (OIV, 2016).
La mayor fuente de cobre en la producción vínica proviene de residuos de pesticidas. Las uvas constituyen una fuente de alimentación rica en azúcares que favorece la proliferación de hongos y oomicetos como el moho gris (Botrytis cinerea), la podredumbre negra (Guignardia bidwellii), el míldiu de la vid (Plasmopara viticola) y el oídio de la vid (Uncinula necator) dando lugar a una disminución tanto en la calidad como en el rendimiento de los cultivos (Komarek, Cadkova, Chrastny, Bordas, & Bollinger, 2010). La mayoría de los pesticidas están basados en cobre ya que es una de las formas más efectivas para combatir las plagas, suelen tener un coste reducido y son fáciles de usar. Además, junto con el sulfito, son los únicos agentes antimicrobianos que la normativa europea permite en la agricultura ecológica (EC.473/2002, 2002). La fórmula más usada es el caldo bordelés o mezcla Bordeaux, formada por sulfato de cobre e hidróxido de calcio, y se estima que lleva utilizándose desde el siglo XVIII (Millardet, 1885). La utilización masiva de este tipo de fungicidas durante décadas ha tenido como consecuencia la acumulación de niveles altos de cobre en el suelo de los viñedos, ya que este metal difícilmente se elimina (Wang et al., 2023). La cantidad de cobre que existe en los suelos de los viñedos varía enormemente entre regiones, estando entre los 50 y 1000 mg/kg en algunos suelos en España y Francia, y llegando a los 3000 mg/kg en algunos viñedos en Brasil (Komarek et al., 2010). Este parámetro está influido por múltiples factores, como, por ejemplo, la edad de los viñedos. Si un viñedo lleva trabajándose durante muchas décadas, la cantidad de cobre que se ha ido acumulando es mayor que en un campo de cultivo más reciente. El clima y la orografía son también factores importantes ya que la lluvia y la erosión retiran parte del cobre que ha sido rociado y obliga muchas veces a tener que realizar varias aplicaciones. En zonas tropicales y subtropicales la humedad hace especialmente sensibles las vides a los hongos patógenos en comparación con zonas más secas, promoviéndose un mayor uso de pesticidas (Wang et al., 2023).
Otra fuente de cobre importante es la adición de sulfato de cobre o citrato de cobre para corregir la reducción de los vinos. Los vinos reducidos tienen un sabor sulfuroso debido a la producción de compuestos volátiles de azufre de bajo peso molecular, como el H2S o los mercaptanos. Este es un sabor nada deseado en los vinos y supone grandes pérdidas económicas para las bodegas. La adición de cobre permite la precipitación de los compuestos azufrados. Aunque en menor medida, los equipos utilizados en el proceso de vinificación, sobre todo los de bodegas artesanales, también pueden contribuir al cobre residual (Wang et al., 2023).
Efecto del cobre sobre la fermentación, el mosto y el vino
El exceso de cobre es una fuente de estrés para las levaduras vínicas y puede alterar la composición del vino. Concretamente, se ha observado que cuando el cobre está a una concentración por encima de 20 mg/L en el mosto puede provocar la ralentización o parada de la fermentación (Capece, Romaniello, Scrano, Siesto, & Romano, 2017; Que et al., 2024; X. Sun et al., 2016). Los azúcares que quedan por consumir pueden ser una oportunidad para otros microorganismos presentes en el mosto, como son las bacterias lácticas, que pueden alterar la composición del vino (Gava, Emer, Ficagna, Fernandes de Andrade, & Fuentefria, 2021). Un menor consumo de azúcares también implica una diminución en la producción de etanol (Que et al., 2024; X. Sun et al., 2016). Las paradas en la fermentación son el principal reto en los procesos de vinificación porque causan daños económicos elevados y una disminución en la calidad del producto final (Gava et al., 2021). Por otro lado, las levaduras producen una mayor cantidad de glicerol, posiblemente para protegerse del estrés (Que et al., 2024). También se ve alterada la composición volátil del vino, aumentando tanto el ácido acético como el dióxido de azufre (Cavazza, Guzzon, Malacarne, & Larcher, 2013). Además, se observa un cambio relevante en la composición metabólica, produciéndose un aumento significativo en la cantidad de aminoácidos y metabolitos secundarios necesarios para las estructuras celulares, reparación del daño y crecimiento celular (Que et al., 2024). La presencia de cobre también puede provocar la oxidación del vino dando lugar a una tonalidad marrón característica que afecta a la calidad del mismo (Wang et al., 2023). Las cepas más resistentes al exceso de cobre apenas presentan alteración en el proceso fermentativo, por lo que la elección de la cepa a utilizar es crucial cuando este metal se halla presente en grandes cantidades (Cavazza et al., 2013; Xiangyu Sun et al., 2019).
Cuando se estudia la toxicidad de un metal como el cobre hay que tener en cuenta la biodisponibilidad de este. En general, se observa que existe una correlación entre la cantidad de cobre presente en el suelo del viñedo, el mosto y el vino. Pero esta correlación no es perfecta, ya que depende de la variedad de la vid, la forma de recolección de las bayas o del proceso de vinificación (Garcia-Esparza, Capri, Pirzadeh, & Trevisan, 2006). Además, durante el proceso de fermentación, la cantidad de cobre presente en el mosto se reduce ya que, por un lado, es adquirido por las levaduras y, por otro lado, forma sulfuros que precipitan y son eliminados por sedimentación junto con las levaduras. No obstante, se comercializan otros productos no fermentados como el zumo de uva o el propio mosto (Ribéreau-Gayon et al., 2021).
Eliminación del cobre del mosto
Si la cantidad de cobre presente supera los límites permitidos, el cobre excedente debe ser eliminado mediante técnicas permitidas por la OIV y la UE. En general, los métodos que existen para la eliminación del cobre consisten en añadir un compuesto al vino que se unirá al cobre formando un complejo que, posteriormente será retirado mediante precipitación y/o filtración (Wang et al., 2023). Aunque algunos son ampliamente utilizados, presentan algunos inconvenientes como la alteración de las propiedades organolépticas del vino. Un ejemplo conocido es el uso de ferrocianuro potásico que se combina con el cobre y con iones de hierro presentes en el vino que dan lugar a compuestos insolubles que son fácilmente retirados. Si el vino no contiene suficiente hierro, no es posible eliminar todo el cianuro sobrante, alterando el producto final y suponiendo un coste para la salud, además de pérdidas económicas importantes (Claus, 2020). Por otro lado, también se utilizan resinas de plantas como la goma arábica, que tiene sabor neutro y evita la precipitación de complejos de cobre, estabilizando el vino. También se utilizan resinas artificiales de polivinilimidazol y polivinilpirrolidona (PVI-PVP), aunque en este caso se ha visto que podrían degradarse parcialmente. Otras sustancias permitidas por la OIV y la UE con este y otros fines son la bentonita, la quitina y el quitosano (Claus, 2020). Un método alternativo para la eliminación del cobre es la bioadsorción, es decir, la captación de metales u otros contaminantes utilizando biomasa viva o muerta. Se ha observado que microorganismos como las levaduras vínicas o las bacterias lactobacilos son capaces de adsorber el cobre del mosto y el vino (Wang et al., 2023). En particular, varios estudios en las últimas décadas se han centrado en el uso de cepas de Saccharomyces cerevisiae (S. cerevisiae) porque su coste de producción es bajo, están adaptadas a las condiciones estresantes de la fermentación, es fácil incrementar su biomasa, son seguras para la salud, no alteran a penas las propiedades organolépticas y constituyen una opción sostenible y ecológica (Capece et al., 2017; Guo et al., 2022; X. Sun et al., 2016). La captación de cobre depende de varios factores, como son, el tipo de cepa, el pH, la cantidad de cobre presente, la composición iónica del medio, el tipo de metabolismo y el estado fisiológico de las levaduras. Se ha observado que las cepas sensibles a cobre acumulan niveles mayores de este metal que las cepas resistentes, lo que sugiere que tienen una mayor capacidad de bioadsorción. Sin embargo, si las cepas son excesivamente sensibles a cobre, estas no son capaces de captar cobre del medio por lo que sería necesario mejorar su tolerancia (Adamo, Brocca, Passolunghi, Salvato, & Lotti, 2012; Capece et al., 2017; X. Y. Sun et al., 2015). Por otro lado, cuando las células están fisiológicamente activas eliminan el cobre del medio de forma más eficiente en comparación con células no vivas (X. Sun et al., 2016). Pero las levaduras muertas tienen la ventaja de no necesitar nutrientes, no ser sensibles a metales pesados y pueden almacenarse durante largos períodos de tiempo. Además, se ha visto que la capacidad de captación de cobre del medio en células muertas puede aumentarse añadiendo grupos fosfato a la pared celular, es decir, incrementando las cargas negativas y, por tanto, la avidez de la pared celular por el cobre (Ojima et al., 2019).
Tolerancia al cobre en la levadura Saccharomyces cerevisiae
La levadura S. cerevisiae es la principal responsable de la fermentación alcohólica del mosto de uva en vino. En este microorganismo, cuando hay niveles bajos de cobre en el medio, su entrada se produce principalmente mediante el transportador de alta afinidad Ctr1 que, necesita que el cobre sea reducido previamente por las metaloreductasas de la membrana plasmática Fre1 y Fre2 (Georgatsou & Alexandraki, 1999). Sin embargo, cuando hay un exceso de cobre, Ctr1 es retirado de la membrana, desaparece su expresión y la entrada en la célula depende principalmente de transportadores de baja afinidad como Fet4 y Smf1, que transportan cationes divalentes como el Cu2+ (Dix, Bridgham, Broderius, Byersdorfer, & Eide, 1994). Debido a la alta toxicidad del cobre, éste no circula libremente por el interior celular, sino que siempre está unido a glutatión (GSH), metalochaperonas específicas de cobre o cuproproteínas. Entre los aceptores de cobre se encuentra la superóxido dismutasa 1 (Sod1) y el transportador Ccc2, que importa cobre al aparato de Golgi, suministrando este metal para el ensamblaje de cuproproteínas. Por otro lado, el cobre también es transportado hacia la mitocondria, la vacuola y a las metalotioneínas (MT), proteínas de bajo peso molecular capaces de unir metales pesados a través de múltiples residuos cisteína (Shi, Jiang, Yang, Peng, & Li, 2021) (Figura 2).
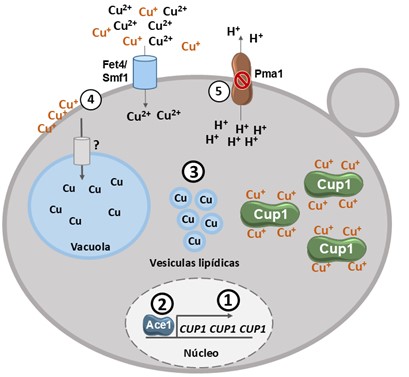
En la levadura S. cerevisiae existen dos MT: Cup1 y Crs5, que constituyen el principal factor de tolerancia al exceso de cobre (Butt et al., 1984; Culotta, Howard, & Liu, 1994). De hecho, uno de los mecanismos de adquisición de tolerancia a cobre más estudiado, observado tanto en levaduras vínicas como de manera experimental en el laboratorio, es el aumento de copias en tándem del gen CUP1 (Adamo et al., 2012) (Figura 3).
Este incremento ocurre con mayor frecuencia si ya existe más de una copia de este gen en tándem, aunque también puede producirse de novo en la región del gen o a través de la duplicación completa o translocación del cromosoma VIII, donde se localiza CUP1 (Chang, Lai, Tung, & Leu, 2013; Gerstein et al., 2015; Longan & Fay, 2024). El principal regulador de la expresión del gen CUP1 es el factor transcripcional Ace1, que también activa la transcripción de otros genes implicados en la detoxificación de cobre, como SOD1 y la ferroxidasa FET3.
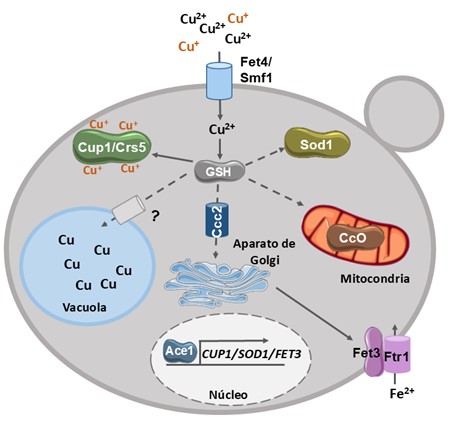
Duplicaciones de ACE1 o cambios en su promotor también se relacionan con una mayor tolerancia al cobre (Chang et al., 2013; Li & Fay, 2019). FET3 codifica una ferroxidasa de cobre que forma parte del complejo de transporte de alta afinidad de hierro junto con Ftr1. Fet3 contiene cobre como cofactor, contribuyendo a atenuar la toxicidad de este metal y, por otro lado, aumenta el transporte de hierro contrarrestando el daño causado por el cobre sobre los centros de hierro-azufre (Fe-S) en la mitocondria (Gaspar-Cordeiro, Marques Caetano, Amaral, Rodrigues-Pousada, & Pimentel, 2018) (Figura 2).
La vacuola también juega un papel relevante en la detoxificación del cobre, como ocurre con otros metales, aunque se desconoce el mecanismo de importación a este orgánulo (Shi et al., 2021). También se ha observado que las levaduras pueden almacenar este metal en vesículas lipídicas en el citosol, aumentando la síntesis de lípidos (He et al., 2022). Por otro lado, estudios recientes sugieren que el almacenamiento en la pared celular podría tener un papel relevante en la tolerancia a este metal, principalmente en condiciones fermentativas (Kim & Lindahl, 2023; Ruta & Farcasanu, 2021; X. Y. Sun et al., 2015). También se ha observado que un mecanismo de adaptación a altas concentraciones de cobre es la alteración del gradiente electroquímico entre el medio externo y el interior celular, para evitar o reducir la entrada de cobre. Pma1 es una bomba de protones de tipo P localizada en la membrana plasmática que exporta protones al medio. Mutaciones de pérdida de función en el gen PMA1 se han detectado en cepas resistentes a exceso de cobre (Gerstein et al., 2015; Longan & Fay, 2024) (Figura 3).
Tolerancia a cobre en otras levaduras enológicas
En la última década ha aumentado considerablemente el interés por las levaduras denominadas “no-convencionales”, es decir, especies más allá del género Saccharomyces como Torulaspora delbrueckii, Metschnikowia pulcherrima o Lachancea thermotolerans entre otras (Maicas & Mateo, 2023). Una de las características comunes de estas levaduras es que tienen una capacidad fermentativa reducida y poca tolerancia al etanol. Sin embargo, su uso se ha popularizado ya que presentan una oportunidad para la industria vínica porque aportan al vino características como bioprotección, mejora de las propiedades organolépticas, bajo contenido alcohólico e impacto positivo sobre la salud. Además, para compensar su bajo rendimiento en la fermentación alcohólica suelen inocularse junto a S. cerevisiae, normalmente de forma escalonada, de modo que predominan en la etapa inicial al mismo tiempo que se asegura la finalización de la fermentación (Maicas & Mateo, 2023). Sin embargo, la tolerancia al cobre de estas especies no se ha estudiado de forma tan detallada como en S. cerevisiae y, en la mayoría de los casos se desconocen los mecanismos moleculares responsables de la misma. Dada la escasa información existente sobre la tolerancia al cobre de las levaduras no convencionales y su elevado interés, aumentar el conocimiento en este campo sería una oportunidad para aprovechar la diversidad en la industria vínica.
Bibliografía
- International Organization of Vine and Wine (OIV). “Maximum acceptable limits of various substances contained in wine”. In Compendium of international methods of analysis of wine and must analysis, 2016, (Vol. 2). París, Francia.
- Adamo, G. M., Brocca, S., Passolunghi, S., Salvato, B., & Lotti, M.: “Laboratory evolution of copper tolerant yeast strains”. Microbial Cell Factories, 2012, 11(1). https://doi.org/10.1186/1475-2859-11-1
- Butt, T. R., Sternberg, E. J., Gorman, J. A., Clark, P., Hamer, D., Rosenberg, M., & Crooke, S. T.: “Copper metallothionein of yeast, structure of the gene, and regulation of expression”. Nati. Acad. Sci. USA, 1984, 81, 3332-3336. https://doi.org/10.1073/pnas.81.11.3332
- Capece, A., Romaniello, R., Scrano, L., Siesto, G., & Romano, P.: “Yeast starter as a biotechnological tool for reducing copper content in wine”. Front Microbiol, 2017, 8, 2632. https://doi.org/10.3389/fmicb.2017.02632
- Cavazza, A., Guzzon, R., Malacarne, M., & Larcher, R.: “The influence of the copper content in grape must on alcoholic fermentation kinetics and wine quality. A survey on the performance of 50 commercial Active Dry Yeasts”. Vitis, 2013, 52(3), 149–155. https://doi.org/10.5073/vitis.2013.52.149-155
- Chang, S. L., Lai, H. Y., Tung, S. Y., & Leu, J. Y.: “Dynamic large-scale chromosomal rearrangements fuel rapid adaptation in yeast populations”. PLoS Genet, 2013, 9(1), e1003232. https://doi.org/10.1371/journal.pgen.1003232
- Chen, J., Jiang, Y., Shi, H., Peng, Y., Fan, X., & Li, C.: “The molecular mechanisms of copper metabolism and its roles in human diseases”. Pflugers Arch, 2020, 472(10), 1415-1429. https://doi.org/10.1007/s00424-020-02412-2
- Claus, H.: “How to deal with uninvited guests in wine: copper and copper-containing oxidases”. Fermentation, 2020, 6(1), 38. https://doi.org/10.3390/fermentation6010038
- Culotta, V. C., Howard, W. R., & Liu, X. F.: “CRSS Encodes a metallothionein-like protein in Saccharomyces cerevisiae”. The Journal of Biological Chemistry, 1994, 269(41), 25295-25302.
- Dix, D. R., Bridgham, J. T., Broderius, M. A., Byersdorfer, C. A., & Eide, D. J.: “The FET4 gene encodes the low affinity Fe(II) transport protein of Saccharomyces cerevisiae”. The Journal of Biological Chemistry, 1994, 269(42), 26092-26099.
- 473/2002. (European Commission) regulation No. 473/2002 amending Annexes I, II and VI to Council Regulation (EEC) No. 2092/91 on organic production of agricultural products and indications referring thereto on agricultural products and foodstuffs, and laying down detailed rules as regards the transmission of information on the use of copper compounds; 2002.
- 1410/2003. (European Commission) Regulation (EC) No. 1410/2003 amending Regulation (EC) No. 1622/2000 laying certain detailed rules for implementing Council Regulation (EC) No. 1493/1999 on the common organization of the markets in wine and establishing a Community code of oenological practices and processes; 2003.
- Festa, R. A., & Thiele, D. J.: “Copper: an essential metal in biology”. Curr Biol, 2011, 21(21), R877-883. https://doi.org/10.1016/j.cub.2011.09.040
- Garcia-Esparza, M. A., Capri, E., Pirzadeh, P., & Trevisan, M.: “Copper content of grape and wine from Italian farms”. Food Addit Contam, 2006, 23(3), 274-280. https://doi.org/10.1080/02652030500429117
- Gaspar-Cordeiro, A., Marques Caetano, S., Amaral, C., Rodrigues-Pousada, C., & Pimentel, C.: “Ace1 prevents intracellular copper accumulation by regulating Fet3 expression and thereby restricting Aft1 activity”. FEBS J, 2018, 285(10), 1861-1872. https://doi.org/10.1111/febs.14450
- Gava, A., Emer, C. D., Ficagna, E., Fernandes de Andrade, S., & Fuentefria, A. M.: “Occurrence and impact of fungicides residues on fermentation during wine production- A review”. Food Addit Contam Part A Chem Anal Control Expo Risk Assess, 2021, 38(6), 943-961. https://doi.org/10.1080/19440049.2021.1894357
- Georgatsou, E., & Alexandraki, D.: “Regulated expression of the Saccharomyces cerevisiae Fre1p/Fre2p Fe/Cu reductase related genes”. Yeast, 1999, 15, 573–584. https://doi.org/10.1002/(SICI)1097-0061(199905)15:7<573::AID-YEA404>3.0.CO;2-7
- Gerstein, A. C., Ono, J., Lo, D. S., Campbell, M. L., Kuzmin, A., & Otto, S. P.: “Too much of a good thing: the unique and repeated paths toward copper adaptation”. Genetics, 2015, 199(2), 555-571. https://doi.org/10.1534/genetics.114.171124
- Guo, X. N., He, X. X., Zhang, L. B., Cheng, Y. F., Bai, X. M., Wang, Z. Y., & He, X. P.: “Enhancement of copper uptake of yeast through systematic optimization of medium and the cultivation process of Saccharomyces cerevisiae”. Appl Biochem Biotechnol, 2022, 194(5), 1857-1870. https://doi.org/10.1007/s12010-021-03775-7
- He, X., Guo, X., Du, Z., Liu, X., Jing, J., Zhou, C., . . . He, X. P.: “Enhancement of intracellular accumulation of copper by biogenesis of lipid droplets in Saccharomyces cerevisiae revealed by transcriptomic analysis”. J Agric Food Chem, 2022, 70(23), 7170-7179. https://doi.org/10.1021/acs.jafc.2c01071
- Kim, J. E., & Lindahl, P. A.: “CUP1 metallothionein from healthy Saccharomyces cerevisiae colocalizes to the cytosol and mitochondrial intermembrane space”. Biochemistry, 2023, 62(1), 62-74. https://doi.org/10.1021/acs.biochem.2c00481
- Komarek, M., Cadkova, E., Chrastny, V., Bordas, F., & Bollinger, J. C.: “Contamination of vineyard soils with fungicides: a review of environmental and toxicological aspects”. Environ Int, 2010, 36(1), 138-151. https://doi.org/10.1016/j.envint.2009.10.005
- Li, X. C., & Fay, J. C.: “Multiple Changes Underlie Allelic Divergence of CUP2 Between Saccharomyces Species”. G3 (Bethesda), 2019, 9(11), 3595-3600. https://doi.org/10.1534/g3.119.400616
- Longan, E. R., & Fay, J. C.: “The distribution of beneficial mutational effects between two sister yeast species poorly explains natural outcomes of vineyard adaptation”. Genetics. 2024. https://doi.org/10.1093/genetics/iyae160
- Maicas, S., & Mateo, J. J.: “The life of Saccharomyces and non-Saccharomyces yeasts in drinking wine”. Microorganisms, 2023, 11(5). https://doi.org/10.3390/microorganisms11051178
- Millardet, A.: “Traitement du mildiou par le mélange de sulphate de cuivre et chaux”. Journal Agriculture Pratique, 1885, 49(2), 707-710.
- Ojima, Y., Kosako, S., Kihara, M., Miyoshi, N., Igarashi, K., & Azuma, M.: “Recovering metals from aqueous solutions by biosorption onto phosphorylated dry baker’s yeast”. Sci Rep, 2019, 9(1), 225. https://doi.org/10.1038/s41598-018-36306-2
- Que, Z., Wei, M., Jiang, W., Ma, T., Zhang, W., Zhao, Z., . . . Sun, X.: “Transcriptomic-metabolomic analysis reveals the effect of copper toxicity on fermentation properties in Saccharomyces cerevisiae”. J Hazard Mater, 2024, 475, 134903. https://doi.org/10.1016/j.jhazmat.2024.134903
- Ribéreau-Gayon, P., Dubourdieu, D., Donèche, B. B., Lonvaud, A. A., Darriet, P., & Towey, J. “The chemistry of wine, stabilization and treatments. Dry extract and minerals”. In Handbook of Enology. 2021, (Vol. 2, pp. 105-125). New York (NY): John Wiley & Sons Ltd.
- Ruta, L. L., & Farcasanu, I. C.: “Saccharomyces cerevisiae concentrates subtoxic copper onto cell wall from solid media containing reducing sugars as carbon source”. Bioengineering (Basel), 2021, 8(3). https://doi.org/10.3390/bioengineering8030036
- Shi, H., Jiang, Y., Yang, Y., Peng, Y., & Li, C.: “Copper metabolism in Saccharomyces cerevisiae: an update”. Biometals, 2021, 34(1), 3-14. https://doi.org/10.1007/s10534-020-00264-y
- Sun, X., Liu, L., Ma, T., Yu, J., Huang, W., Fang, Y., & Zhan, J.: “Effect of high Cu2+ stress on fermentation performance and copper biosorption of Saccharomyces cerevisiae during wine fermentation”. Food Science and Technology, 2019, 39(1), 19-26. https://doi.org/10.1590/1678-457x.24217
- Sun, X., Liu, L., Zhao, Y., Ma, T., Zhao, F., Huang, W., & Zhan, J.: “Effect of copper stress on growth characteristics and fermentation properties of Saccharomyces cerevisiae and the pathway of copper adsorption during wine fermentation”. Food Chem, 2016, 192, 43-52. https://doi.org/10.1016/j.foodchem.2015.06.107
- Sun, X. Y., Zhao, Y., Liu, L. L., Jia, B., Zhao, F., Huang, W. D., & Zhan, J. C.: “Copper Tolerance and Biosorption of Saccharomyces cerevisiae during Alcoholic Fermentation”. PLoS One, 2015, 10(6), e0128611. https://doi.org/10.1371/journal.pone.0128611
- Wang, J., Ma, T., Wei, M., Lan, T., Bao, S., Zhao, Q., . . . Sun, X.: “Copper in grape and wine industry: Source, presence, impacts on production and human health, and removal methods”. Compr Rev Food Sci Food Saf, 2023, 22(3), 1794-1816. https://doi.org/10.1111/1541-4337.13130
Agradecimientos
Esta publicación es parte de los proyectos de I+D+i CEX2021-001189-S, PID2020-116940RB-I00, y PID2023-148124OB-I00 financiados por MICIU/AEI/10.13039/501100011033; y el proyecto TED2021-131349B-I00 financiado por MICIU/AEI/10.13039/501100011033 y por la Unión Europea Next Generation EU / PRTR.
Las figuras utilizadas contienen iconos de Servier Medical Art bajo la licencia CC BY 4.0.