Introducción
La industria del vino es una seña de identidad de nuestro país, siendo uno de los sectores agroalimentarios más importantes de España y del sur de Europa. La constante necesidad de innovación en el sector vitivinícola para satisfacer las demandas de los consumidores ha generado una fuerte competitividad en el mercado. Por tanto, el sector vitivinícola español debe mejorar las condiciones de producción, seguridad y calidad del vino manteniendo su tipicidad. Por otra parte, la creciente demanda de productos naturales está planteando a la industria alimentaria el desafío de proporcionar alimentos inocuos, saludables y mínimamente procesados.
Esta nueva tendencia ha llegado a la industria vitivinícola en ámbitos como la búsqueda de un nuevo método de higienización de madera y corcho de empleo enológico. En este sentido, el uso de depósitos y de barricas de madera de roble en la elaboración y crianza de vinos es una práctica que se considera un elemento muy favorable en la evolución organoléptica de los vinos. Durante la elaboración y crianza en madera de roble, los intercambios vino-madera enriquecen el producto en aromas y sensaciones gustativas, además de provocar una microoxigenación que favorece la estabilización fisicoquímica del vino y de aportar delicadeza, equilibrio y complejidad aromática tan apreciadas por el consumidor. Una barrica usada no tiene el mismo potencial enológico que una nueva, pero sigue teniendo un excelente valor de uso para la elaboración de numerosos vinos, por lo que su buen mantenimiento es fundamental para este fin. Los problemas que surgen durante la crianza del vino están esencialmente asociados a la contaminación microbiológica o química ya que la porosidad de la madera de roble dificulta su desinfección y limpieza. Se ha establecido que una barrica usada de 225 litros contiene unos 5 litros de vino retenidos en los primeros milímetros de las duelas, lo que representa un volumen de vino muy importante que no puede considerarse despreciable.
Esa estructura microporosa de la madera, especialmente en el roble francés, favorece la penetración de microorganismos en profundidad y dificulta su limpieza y desinfección. Esto es especialmente crítico en el caso de contaminación del vino por Brettanomyces, que es una levadura que causa el carácter fenólico del vino. El problema sensorial de los fenoles volátiles es un tema que afecta especialmente a los vinos de crianza o a aquellos que pasan algún tiempo en barricas de crianza. Los descriptores típicos del carácter fenólico del vino son: plástico, plástico quemado, farmacia, animal, estiércol, corral, establo, sudor de caballo, perro mojado, calcetines sucios, etc. No solamente la estructura porosa de la madera puede suponer un riesgo de contaminación microbiana, sino que, además, cuando los depósitos de tartrato formados durante el envejecimiento se adhieren acumulativamente a las paredes internas del depósito o de la barrica pueden servir como refugio para microorganismos potencialmente contaminantes.
El azufrado ha sido la práctica más utilizada en las bodegas para la desinfección de los depósitos de madera y barricas. Se utiliza desde la época de los romanos y ayuda a mantener el parque de barricas en buen estado frente a los microorganismos alterantes, aunque no ha llegado a ser tan efectivo como para erradicar las contaminaciones de Brettanomyces. La forma tradicional de aplicación es la quema de una pastilla de azufre dentro de barricas vacías. La combustión de azufre produce dióxido de azufre, que es el que tiene efecto biocida. Sin embargo, la aparición de la Directiva 98/8/CE2 de la Comisión Europea, que prohíbe el uso de dióxido de azufre para la higienización de barricas, ha llevado a la necesidad de búsqueda de alternativas que permitan que esta tarea sea eficaz y viable desde un punto de vista económico y operativo. Aunque en España existe un acuerdo de moratoria sobre la prohibición del uso de azufre en la higienización de barricas de vino hasta 2025, este escenario ha propiciado el desarrollo de nuevas tecnologías alternativas para la higienización de barricas (térmica, ozono, ultrasonidos, microondas). Sin embargo, ninguna de ellas ha podido responder adecuadamente a las necesidades del sector vitivinícola.
La correcta higienización de barricas no es el único problema de la industria enológica actual, sino que la contaminación de bodegas y vinos con moléculas organocloradas que pueden estar vinculadas al empleo de corcho natural y madera es otro de los problemas importantes a resolver (Mazzoleni y Maggi, 2007). En cuanto al corcho, las contaminaciones por clorofenoles que afectan al sector del vino pueden proceder directamente de los alcornoques o de contaminaciones cruzadas durante su fabricación o almacenaje en la propia bodega. Por otra parte, determinados hongos filamentosos sintetizan cloroanisoles que son compuestos aromáticos que deterioran la calidad del vino (como el 2,4,6 tricloroanisol o TCA). Aunque se han desarrollado tecnologías para el tratamiento del corcho (Taylor et al., 2000; Corsi et al., 2016), la mayoría se han centrado en la eliminación de un único tipo de cloroanisol (TCA) y además de no resultar muy eficaces, son muy destructivas. Una de las propuestas para mejorar los resultados de aplicación de este tipo de tecnologías es reducir la carga microbiana responsable de la aparición de estos compuestos (Álvarez-Rodríguez et al., 2002); o la eliminación de estas moléculas con técnicas más eficaces y menos destructivas (Vestner et al., 2010; Fang et al., 2016).
Por lo tanto, resultaría muy interesante estudiar nuevas formas de destrucción de aquellos microorganismos, o de sus metabolitos, que puedan perjudicar las características organolépticas del vino, pero sin afectar a su calidad, con tecnologías emergentes (Clodoveo et al., 2016). Una de estas tecnologías, es el uso del plasma atmosférico frío (PAF).
La tecnología PAF se presenta como una herramienta para la desinfección de alimentos y/o de los materiales y ambientes que entran en contacto con ellos, sin la pérdida de sus propiedades sensoriales o fisicoquímicas. El plasma, que es el cuarto estado de la materia, está compuesto por iones positivos y negativos, electrones, átomos excitados y neutros, radicales libres, moléculas en los estados fundamental y excitado y fotones UV. En los últimos años, se ha testado científicamente el plasma frío en desinfección microbiana e inactivación enzimática de alimentos, en mejora de la calidad de cocción de variedades de arroz, modificación del almidón, mejora de la germinación de semillas, etc. (Thirumdas et al., 2014).
La mayoría de los estudios sobre la actividad antimicrobiana del plasma se han realizado aplicando el plasma directamente sobre los alimentos o superficies que lo contienen. Aunque se ha realizado algún estudio sobre su aplicación directa a productos de madera como barricas, nunca se había aplicado a nivel industrial. No obstante, existen ocasiones en las que la aplicación directa de una fuente de plasma no es técnicamente factible o no es industrialmente rentable. Este es el caso, por ejemplo, del tratamiento con plasma del interior de una barrica, ya que, para poder introducir el equipo de plasma en su interior, habría que desmontar al menos uno de sus frentes, lo que resultaría prácticamente inviable para cualquier bodega. Por ello son tan interesantes lo estudios recientes de aplicación de agua activada por plasma (AAP) como agente desinfectante y purificante de madera de barricas y corchos respectivamente.
Considerando todo lo anterior, se pensó que el AAP podría ser una solución para la desinfección de barricas, permitiendo su reutilización sin problemas sanitarios, y para la eliminación del TCA en los corchos, estableciendo un procedimiento que no requiera altas temperaturas y presiones, y elevados tiempos de tratamiento, evitando las deformaciones irreversibles en los corchos que provocan la mayoría de las tecnologías evaluadas hasta el momento. Por tanto, el objetivo del presente estudio fue verificar la eficacia de la tecnología AAP para inactivar Brettanomyces bruxellensis en barricas de vino contaminadas naturalmente y demostrar la capacidad del AAP para descomponer y eliminar el TCA, proporcionando así nuevas estrategias de descontaminación para combatir estos conocidos problemas en la industria del vino.
Materiales y métodos
Muestras de madera de barrica y corchos
Las duelas se extrajeron de barricas de roble empleadas en la producción de vino de crianza que estaban naturalmente contaminadas. Las muestras de este estudio consistieron en fragmentos de 5 × 5 cm que fueron cortadas de las duelas, una vez desmontadas las barricas. Se determinó que la contaminación media por Brettanomyces de una muestra configurada por 4 fragmentos de duelas fue de 4,35 ± 0,26 unidades logarítmicas de células viables por gramo de madera, como punto de partida.
Por otro lado, se emplearon tapones de corcho 100% natural (para botellas de vino de 750 mL). Se analizaron algunos de los corchos de la serie empleada para descartar la presencia de polihaloanisoles y polihalofenoles, siendo el resultado negativo en todos los casos. Para preparar las muestras de corcho del estudio, se sumergieron 4 corchos sin contaminación en recipientes de cristal de 95 gramos con 80 mL de una solución preparada con 400 ng/L de TCA. Se dispusieron los recipientes en un agitador rotativo a 50 rpm durante 5 horas. Una vez finalizado el tratamiento, se analizó individualmente cada corcho. La concentración media de TCA de los 4 corchos contaminados artificialmente fue de 26,59 ± 1,64 ng/L.
Preparación de las AAP
El equipo PAF utilizado en este estudio fue el PlasmaSpot500 (Molecular Plasma Group, Foetz, Luxemburgo). Se compone de dos electrodos cilíndricos con un tubo dieléctrico de óxido de aluminio entre ellos. El electrodo interno está conectado a tierra y el externo está conectado a una fuente de alto voltaje. El AAP se produjo exponiendo 2000 mL de agua purificada (AP) al chorro de plasma, como se muestra en la figura 1. Se generaron cuatro AAP diferentes variando el tiempo de generación: 1,5; 5; 15 y 30 minutos , lo que resultó en muestras etiquetadas como AAP-1,5, AAP-5, AAP-15 y AAP-30, respectivamente. Para todos los tratamientos, se utilizó aire a 60 slm como gas de plasma y la potencia del plasma se fijó en 500 W. La distancia entre la superficie de AP y el final de la boquilla de plasma se mantuvo constantemente en 30 mm.
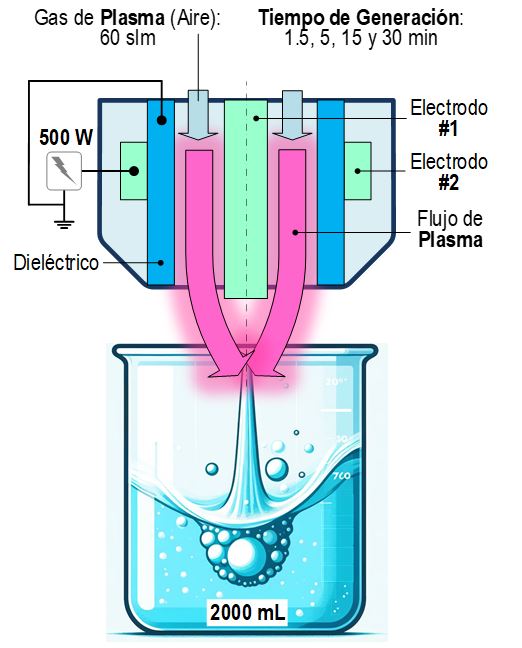
Tratamientos aplicados para la inactivación microbiana de la madera
El tratamiento con sulfuroso (tratamiento de referencia) se realizó en un frasco de cristal de 4 litros de capacidad en el que se introdujeron 3 fragmentos contaminados (5 x 5 cm). Se colgó una pastilla de azufre de 5 gramos, que se prendió con un mechero, despidiendo así vapores de SO2. Se tapó el bote herméticamente con su tapa y parafina y se mantuvo durante 30 minutos.
Para los tratamientos de inmersión con AAP se introdujeron 3 fragmentos contaminados naturalmente en recipientes con 250 mL de las AAP descritas en el apartado anterior. La cara correspondiente al interior de la barrica quedó totalmente sumergida hasta los 3 cm. Se consideraron 5 tratamientos por inmersión durante 3 horas: 1 con agua destilada (AD, control) y 4 con AAP (AAP-1,5, AAP-5, AAP-15 y AAP-30) en estático.
Tratamientos aplicados para la reducción de TCA en los corchos
Se consideraron 5 tratamientos por inmersión: 1 con agua destilada (AD, control) y 4 con AAP (AAP-1,5, AAP-5, AAP-15 y AAP-30). Se emplearon AAP similares a las utilizadas para la desinfección de las barricas de madera. Para cada tratamiento se emplearon 3 corchos contaminados artificialmente que se sumergieron individualmente en recipientes de cristal de 95 gramos con 80 mL de cada tipo de solución (AP y 4 AAP) durante 3 horas en estático.
Análisis de la inactivación microbiana del AAP
Tras las 3 horas de tratamiento de inmersión, se extrajeron las duelas y se cepillaron hasta 10 mm de profundidad. Se recogieron las virutas en bolsas de plástico estériles y se pesaron para conocer el peso de virutas recogidas de cada muestra. A continuación, se colocó cada bolsa con la boca abierta dentro de un bote de conserva estéril y se añadieron 600 mL de TSB (caldo de triptona de soja, medio de recuperación) atemperado, cerciorándose de que la viruta quedaba bien empapada. Se sometieron los botes con las bolsas a agitación orbital durante 24 h a 28 ºC y a 80-100 rpm. Tras ese tiempo de infusión, se sacaron los botes con las virutas del orbital, se extrajo el TSB infusionado de cada muestra en la cabina de flujo laminar en condiciones de asepsia. Se tamizó el medio de cultivo infusionado por un visillo estéril y se colocó en botes de centrífuga estériles, que se centrifugaron a 4 ºC, 30 min y 10.000 g. Tras la centrifugación se eliminó el sobrenadante de forma inmediata y se resuspendió el sedimento en solución de Ringer, enrasando a un volumen de 15 mL en tubos de plástico estériles. Finalmente, se analizaron las muestras en Excell Ibérica (Logroño, España), primero realizando el tratamiento correspondiente con PMA (monoazida de propidio) y la extracción del ADN de las muestras. Una vez extraído el ADN, se realizó la PCR cuantitativa con EvaGreen, expresando los resultados de la población de Brettanomyces viables en unidades genómicas por gramo de madera.
Análisis de polihaloanisoles y polihalofenoles
Se analizaron todos los corchos del estudio (corchos contaminados artificialmente, tratados con AP y con AAP) siguiendo los métodos de análisis químicos OIV-MA-AS315-16 (Determinación del 2,4,6-tricloroanisol cedido al vino por los tapones de corcho, Resolución OIV/OENO 296/2009) y OIV-MA-AS315-17 (Determinación de los policlorofenoles y de los policloroanisoles en los vinos, los tapones, las maderas y las bentonitas utilizadas como adsorbente de estos compuestos en la atmosfera, Resolución OIV/OENO 374/2009) correspondientes al “Compendio de los métodos internacionales de análisis de los vinos y de los mostos” de la Organización Internacional de la Viña y el Vino (OIV). Estos métodos simulan los fenómenos de migración del 2,4,6-tricloroanisol (TCA), 2,4,6-triclorofenol, 2,3,4,6-tetracloroanisol, 2,3,4,6-tetraclorofenol, pentacloroanisol y pentaclorofenol susceptibles de producirse entre el tapón de corcho y el vino embotellado. Se ponen a macerar los tapones de corcho en una solución hidroalcohólica hasta la obtención de un equilibrio. Se extraen los polihaloanisoles y polihalofenoles del espacio de cabeza de una parte alícuota del macerado por medio de la técnica de microextracción en fase sólida (SPME) y se analiza por cromatografía en fase gaseosa, con detección por espectrometría de masas (GC/MS).
Análisis estadístico
Todos los experimentos se realizaron por triplicado. El análisis estadístico de los datos se realizó utilizando el software Statgraphics Centurion (v19, The Plains, EE.UU.). Se utilizó el ANOVA, con comparaciones post hoc utilizando la prueba LSD de Fisher, y un valor de p < 0,05 para analizar las diferencias estadísticamente significativas.
Resultados y discusión
Inactivación de B. bruxellensis mediante tratamiento con AAP de la madera de roble
La figura 2 muestra la disminución en la población de B. bruxellensis después de 3 horas de inmersión en cada tipo de AAP y los controles (AP y SO2). En ninguno de los controles utilizados en este estudio (tratamiento con AP y SO2) se observó una reducción significativa. Sin embargo, la población de B. bruxellensis se redujo de manera significativa en las muestras tratadas con AAP (se encontraron diferencias estadísticamente significativas entre cada tratamiento con AAP y cada control).
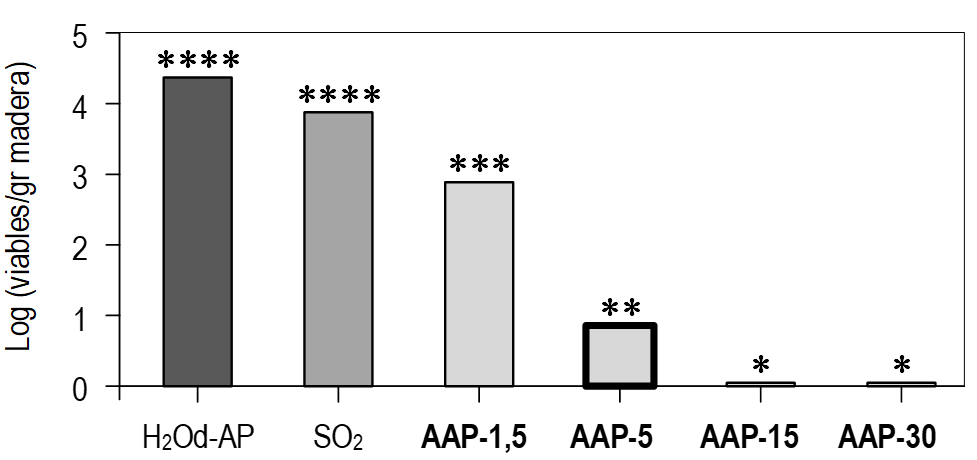
En concreto, se logró una reducción de 1,46 ± 0,27 unidades logarítmicas por gramo de madera con AAP-1,5, mientras que se observaron reducciones de 3,49 ± 0,83 log con AAP-5, y se logró la inactivación total (4,35 ± 0,00 log) con AAP generada durante 15 y 30 minutos. Se encontraron diferencias estadísticamente significativas entre los tratamientos con AAP, excepto en el caso de APP-15 y APP-30. Este hallazgo coincide con Guo et al. (2017), quienes observaron una mayor inactivación de S. cerevisiae en las uvas al utilizar APP generada durante períodos más largos (30 y 60 minutos). Asimismo, otros autores (Tian et al., 2017) lograron reducciones de 0,38 ± 0,17 y 0,53 ± 0,07 log UFC/mL después de 30 minutos de contacto APP/levadura, y también obtuvieron mayores reducciones después de tiempos de tratamiento más prolongados, sugiriendo que la eficacia del AAP para la inactivación microbiana podría depender del tiempo de generación.
Las características fisicoquímicas de cada tipo de APP desempeñan un papel clave para entender por qué la respuesta de los microorganismos no es uniforme entre las AAP. A mayor tiempo de tratamiento, se han descrito mayores concentraciones de especies reactivas como OH•, NO• y NO2• (Sainz-García et al., 2024). Estas especies reactivas, junto con el peroxinitrito, exhiben una fuerte actividad antimicrobiana (Machala et al., 2013; Bao et al., 2016), capaces de desencadenar reacciones de oxidación y nitración en células biológicas, incluyendo peroxidación de lípidos, proteínas y daño al ADN (Lukes et al., 2014; Shen et al., 2016; Thirumdas et al., 2018). Otros investigadores han sugerido que la muerte de la levadura podría atribuirse al efecto de las especies reactivas de nitrógeno y oxígeno en los antioxidantes, daño a la membrana y alteración de la estructura celular (Zhang et al., 2020; Liu et al., 2021).
Degradación de las moléculas organocloradas en corchos por AAP
La figura 3 muestra la concentración promedio de TCA en muestras de corcho después de 3 horas de contacto con AAP y AP, comparado con la concentración de TCA en corchos secos contaminados (control). Durante el período de generación del AAP más corto (AAP-1,5) solo se eliminó el 18,1 % del TCA. Para AAP-5 y AAP-30, no hubo diferencias estadísticamente significativas, logrando una eliminación del 75,2 % y 72,6 %, respectivamente; mientras que para AAP-15, la degradación fue un poco menor, un 65,0 %. Finalmente, los corchos tratados con AP no mostraron cambios significativos en el contenido de TCA en comparación con el control, lo que indica que no hubo efecto de lavado.
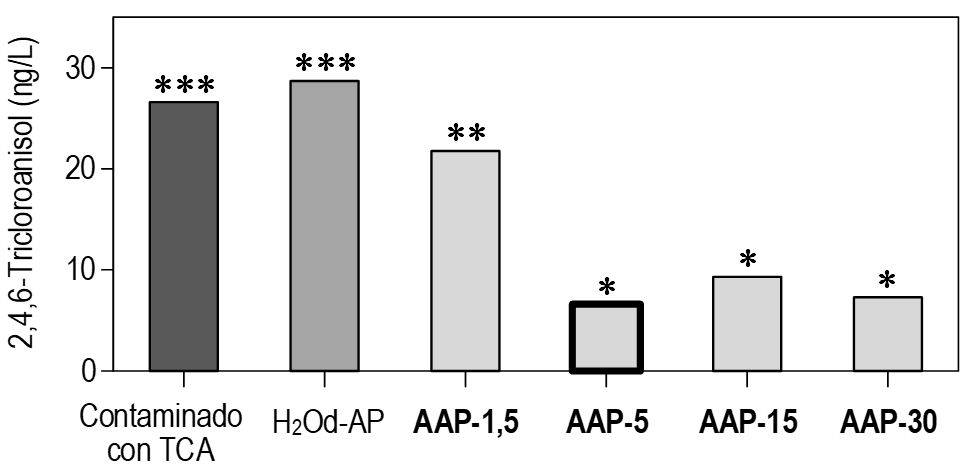
Aunque no se ha investigado ampliamente la tecnología AAP para la descomposición o degradación de la molécula de TCA, algunos autores han estudiado cómo descomponer las moléculas de TCA utilizando principalmente la ozonización. Por ejemplo, Peter y Von Gunten (2007) observaron una mayor descomposición del TCA al aumentar la exposición al agua ozonizada durante la eliminación de sabores desagradables. Qi et al. (2009) informaron una descomposición del 86 % del TCA en agua potable después de 10 minutos de ozonización con bauxita cruda como catalizador, sugiriendo que la generación de OH• fue crucial para la degradación del TCA. Además, Xu y Qi (2016) estudiaron la eliminación del TCA en ozonización catalítica mediante g-AlOOH en agua, logrando una reducción del 79,3 %, donde el OH• se identificó como la especie reactiva principal que ataca al TCA. Estudios llevados a cabo por Sainz-García et al. (2023) confirman esta afirmación, sugiriendo que la eliminación del TCA podría atribuirse principalmente a la presencia de OH• en cada tipo de AAP.
Después de demostrar con éxito la capacidad del AAP para eliminar el TCA de los corchos, se estudió si el AAP también podía descomponer otras moléculas, como cloroanisoles y clorofenoles.
La figura 4 ilustra la concentración promedio de moléculas de cloroanisol después de 3 horas en contacto con AAP y el control de corcho seco contaminado. En general, se observaron altos niveles de descomposición independientemente del tipo de cloroanisol analizado o del tipo de AAP utilizado.
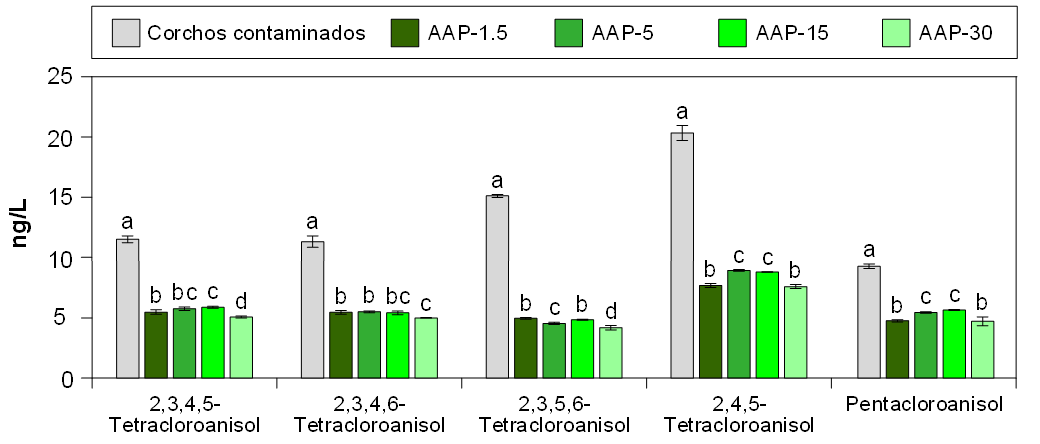
La figura 5 muestra la concentración promedio de moléculas de clorofenol después de 3 horas en contacto con AAP y corchos secos contaminados (control). De manera similar a los resultados obtenidos para los cloroanisoles, se confirmó que los tratamientos con AAP lograron descomponer casi la totalidad de las moléculas de clorofenol analizadas. Comparando las figuras 4 y 5, se puede observar un mayor grado de descomposición de los clorofenoles en comparación con los cloroanisoles. Esto podría explicarse porque el grupo –OH de la molécula de fenol es más reactivo hacia moléculas polares, como el OH•, que el grupo –OCH3 del anisol (Revolution, 2021).
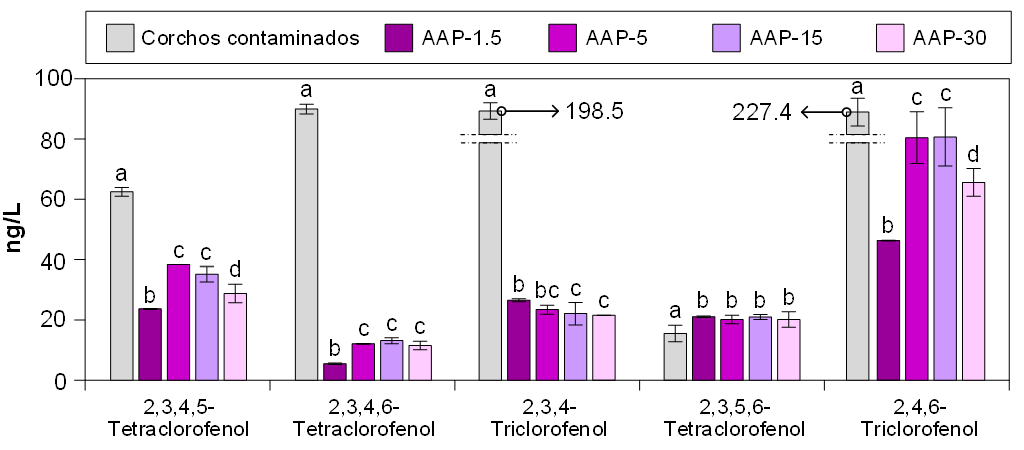
Entre todas las moléculas de clorofenol estudiadas, el 2,4,6-triclorofenol (TCF) es especialmente significativo, ya que es el precursor de la formación de TCA. Saritha et al. (2009) y Kavitha y Palanivelu (2016) investigaron su eliminación utilizando procesos de oxidación avanzados como el UV/Fenton y el foto-Fenton, respectivamente, observando una alta descomposición del TCF, lo que subraya el papel crítico del OH• en estos procesos.
Finalmente, cabe destacar que el porcentaje de reducción de moléculas de cloroanisol y clorofenol fue bastante similar al aplicar un tratamiento con AAP generado durante un tiempo de activación del plasma igual o superior a 5 minutos (AAP-5, AAP-15 y AAP-30). Considerando la eficiencia energética y la sostenibilidad, el AAP-5 se podría describir como el tratamiento más óptimo desde el punto de vista económico y ecológico.
Conclusiones
En este estudio se ha investigado el uso del AAP como una tecnología sostenible y económica para reutilizar barricas de madera de roble durante el proceso de envejecimiento del vino y para eliminar componentes relacionados con el olor a corcho. Nuestros resultados demostraron que a tiempos de generación del AAP más largos, mayor inactivación de B. bruxellensis. Se seleccionó el AAP generado durante 5 minutos y 3 horas de contacto AAP/madera como el tratamiento más efectivo y rápido, ya que logró una reducción de 3,23 log en B. bruxellensis. Por lo tanto, la inactivación de B. bruxellensis en barricas de roble con AAP podría ser una alternativa al sulfuroso en el mantenimiento de las barricas.
En este estudio, además, se confirmó que el tratamiento con AAP resultó ser un método eficaz para eliminar TCA y otras moléculas problemáticas de corchos contaminados artificialmente. El tratamiento más eficaz fue, de nuevo, el AAP generada durante 5 minutos de activación del plasma, sumergiendo individualmente los corchos contaminados durante 3 horas.
En conclusión, la reducción de la viabilidad de B. bruxellensis y la descomposición de moléculas de cloroanisol y clorofenol con AAP podría representar una solución emergente para reducir el número de botellas de vino desechadas en las bodegas debido a estos problemas.
Agradecimientos
Esta publicación es parte de los proyectos de I+D+i PID2019-105367RBC21 y PID2019-105367RBC22, financiados por MCIN/ AEI/10.13039/501100011033. La autora Ana Sainz-García agradece los contratos del programa predoctoral para la formación de personal investigador financiados por el Ministerio de Ciencia e Innovación de España.
Bibliografía
- Álvarez-Rodríguez, M.L., López-Ocaña, L., López-Coronado, J.M., Rodríguez, E., Martínez, M.J., Larriba, G., Coque, J.-J.R.: “Cork Taint of Wines: Role of the Filamentous Fungi Isolated from Cork in the Formation of 2,4,6-Trichloroanisole by O Methylation of 2,4,6-Trichlorophenol”. Environ. Microbiol., 2002; 68, 5860–5869.
- Bao, P., Lu, X., He, M., & Liu, D.: “Kinetic analysis of delivery of plasma reactive species into cells immersed in culture media”. IEEE Transactions on Plasma Science, 2016; 44 (11), 2673–2681.
- Clodoveo, M.L., Dipalmo, T., Rizzello, C.G., Corbo, F., Crupi, P.: “Emerging technology to develop novel red winemaking practices”. An overview. Food Sci. Emerg. Technol. 2016; 38, 41–56.
- Corsi, A.J., Robles Hernandez, F.C., Cordúa y Cruz, G., Neal, J.A.: “The effectiveness of electron beam irradiation to reduce or eliminate mould in cork stoppers. J. Food Sci. Technol., 2016; 51, 389–395.
- Fang, L., Hallam, D., Bermúdez, R.: “Experimental studies on removal of airborne haloanisoles by non-thermal plasma air purifiers”. Energy Build. 2016; 130, 238–243.
- Kavitha, V., Palanivelu, K.: “Degradation of phenol and trichlorophenol by heterogeneous photo-Fenton process using Granular Ferric Hydroxide®: comparison with homogeneous system”. J. Environ. Sci. Technol. 2016; 13 (3), 927–936.
- Liu, X., Li, Y., Zhang, R., Huangfu, L., Du, G., & Xiang, Q.: “Inactivation effects and mechanisms of plasma-activated water combined with sodium laureth sulfate (SLES) against Saccharomyces cerevisiae”. Applied Microbiology and Biotechnology, 2021; 105(7), 2855–2865.
- Lukes, P., Dolezalova, E., Sisrova, I., & Clupek, M.: “Aqueous-phase chemistry and bactericidal effects from an air discharge plasma in contact with water: Evidence for the formation of peroxynitrite through a pseudo-second-order post-discharge reaction of H2O2 and HNO2“. Plasma Sources Science and Technology, 2014; 23(1).
- Machala, Z., Tarabova, B., Hensel, K., Spetlikova, E., Sikurova, L., & Lukes, P.: “Formation of ROS and RNS in water electro-sprayed through transient spark discharge in air and their bactericidal effects”. Plasma Processes and Polymers, 2013; 10(7), 649–659.
- Mazzoleni, V., Maggi, L.: “Effect of wine style on the perception of 2,4,6-trichloroanisole, a compound related to cork taint in wine”. Food Res. Int. 2007; 40, 694–699.
- Compendium of International Methods of Analysis-OIV Alkalinity of Ash, 2009; vol. 2. International Organisation of Vine and Wine.
- Peter, A., Von Gunten, U.: “Oxidation kinetics of selected taste and odor compounds during ozonation of drinking water”. Sci. Technol. 2007; 41 (2), 626–631.
- Qi, F., Xu, B., Chen, Z., Ma, J., Sun, D., Zhang, L., Wu, F.: “Ozonation catalyzed by the raw bauxite for the degradation of 2,4,6-trichloroanisole in drinking water”. Hazard Mater. 2009; 168 (1), 246–252.
- Revolution, E., 2021. Why OH group shows MORE +R than OCH3. Retrieved June 1, 2023, from. https://edurev.in/question/264878/Why-OH-group-shows-MORE-R-than-OCH3#:~:text=The OH group is more acidic%2C nucleophilic%2C and can form, versatile than the OCH3 group.
- Sainz-García, A., González-Marcos, A., Múgica-Vidal, R., Muro-Fraguas, I., Gallarta-González, F., González-Arenzana, L., López-Alfaro, I., Santamaría, P., Escribano-Viana, R., Sainz-García, E., & Alba-Elías, F.: “Wine corks decontamination using plasma activated water”. Current Research in Food Science, 2023; 7.
- Sainz-García, A., González-Marcos, A., Muro-Fraguas, I., Múgica-Vidal, R., Alba-Elías, F., Sainz-García, E., Gallarta-González, F., González-Arenzana, L., López-Alfaro, I., Santamaría, P., & Escribano-Viana, R.: “Plasma Activated Water for wine barrels disinfection”. LWT, 2024; 198.
- Saritha, P., Raj, D.S.S., Aparna, C., Laxmi, P.N.V., Himabindu, V., Anjaneyulu, Y.: “Degradative oxidation of 2,4,6 trichlorophenol using advanced oxidation processes -a comparative study”. Water Air Soil Pollut. 2009; 200 (1–4), 169–179.
- Shen, J., Tian, Y., Li, Y., Ma, R., Zhang, Q., Zhang, J., et al.: “Bactericidal effects against S. aureus and physicochemical properties of plasma activated water stored at different temperatures”. Scientific Reports, 2016; 6(March).
- Taylor, M.K., Young, T.M., Butzke, C.E., Ebeler, S.E.: “Supercritical Fluid Extraction of 2,4,6-Trichloroanisole from Cork Stoppers”. Agric. Food Chem. 2000; 48, 2208–2211.
- Thirumdas, R., Sarangapani, C., & Annapure, U. S.: “Cold Plasma: A novel Non-Thermal Technology for Food Processing”. Food Biophysics, 2014; 11p.
- Thirumdas, R., Kothakota, A., Annapure, U., Siliveru, K., Blundell, R., Gatt, R., & Valdramidis, V. P.: “Plasma activated water (PAW): Chemistry, physico-chemical properties, applications in food and agriculture”. Trends in Food Science & Technology, 2018; 77, 21–31.
- Vestner, J., Fritsch, S., Rauhut, D.: “Development of a microwave assisted extraction method for the analysis of 2,4,6-trichloroanisole in cork stoppers by SIDA–SBSE–GC–MS”. Chim. Acta 2010; 660, 76–80.
- Tian, Y., Guo, J., Wu, D., Wang, K., Zhang, J., & Fang, J.: “The potential regulatoryeffect of nitric oxide in plasma activated water on cell growth of Saccharomyces cerevisiae”. Journal of Applied Physics, 2017; 122(12).
- Xu, B., Qi, F.: “Reaction mechanism of 2-methylisoborneol and 2,4,6-trichloroanisole in catalytic ozonation by γ-AlOOH: role of adsorption”. Clean 2016; 44 (9), 1099–1105.
- Zhang, R., Ma, Y., Wu, D., Fan, L., Bai, Y., & Xiang, Q.: “Synergistic inactivation mechanism of combined plasma-activated water and mild heat against Saccharomyces cerevisiae”. Journal of Food Protection, 2020; 83(8), 1307–1314.